荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
急性T淋巴细胞白血病(T-cell acute lymphoblastic leukemia, T-ALL) 和T淋巴母细胞淋巴瘤(T-cell lymphoblastic lymphoma, T-LBL)是具有高度侵袭性的T系恶性肿瘤。由于正常T细胞和恶性T细胞之间共有的抗原性,目前仍然缺乏针对T细胞恶性肿瘤的获批CAR-T疗法。
CD19 STAR-OX40-T治疗R / R B-ALL效果显著
2022年5月1日,陆道培医院陆佩华教授团队和清华大学医学院林欣教授团队合作在美国著名血液学杂志American Journal of Hematology 发表新型CD19靶向STAR-T细胞治疗R/R B-ALL的研究论文,该项研究的临床前研究以及临床研究用STAR-T和STAR-OX40-T细胞均由清华大学(医学院)和华夏英泰生物科技公司研发和制备。
研究背景
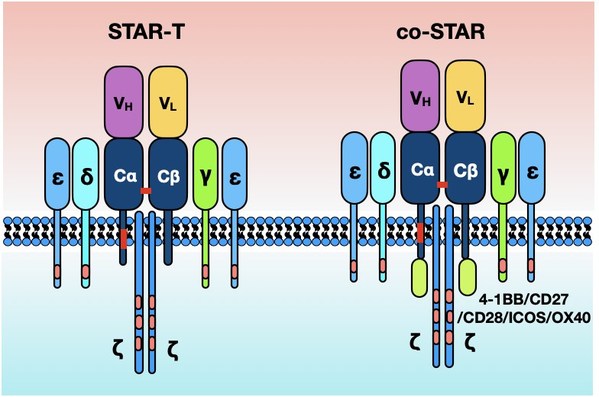
CAR-T细胞疗法在B细胞恶性肿瘤患者中已显示出高应答率,但缓解持续时间和安全性仍待提高。研究者开发了一种新型的双链嵌合受体——STAR,由2个蛋白质模块组成,每个模块均包含抗体轻链或重链可变区,融合的T细胞受体(TCR)a 和 b链恒定区与OX40共刺激域结合,通过自裂解弗林蛋白酶-p2A序列连接的2个模块,允许模块通过蛋白水解分离和重组。这项研究报告了STAR-T细胞疗法的临床前研究和CD19 STAR-OX40-T细胞治疗难治/复发(R/R)急性B细胞淋巴细胞白血病(B-ALL)的I期临床研究结果。
研究方法
从健康供体和患者分别获得外周血(PB)单核细胞,用于临床前和临床研究;应用慢病毒载体把STAR结构转导至T细胞获得STAR-T细胞,并利用白血病异种移植小鼠模型评估STAR-T细胞抗肿瘤功能。从2019年12月至2020年6月,该试验共入组18例CD19 + R / R B-ALL患者(男女比例为10:8),中位年龄为22.5岁。在输注STAR-OX40-T细胞前,患者接受3日的静脉注射氟达拉滨(25mg/m2·d)和环磷酰胺(250mg/m2·d)的预处理治疗。在患者达到完全缓解(CR)后,可以选择是否继续进行巩固性的异体造血干细胞移植(allo-HSCT)。
研究结果
临床前研究结果
在临床前细胞水平研究中发现CD19 STAR-T细胞在靶细胞的刺激下,其展示出更快的活化时间,更高的细胞因子分泌量以及更好的肿瘤杀伤效果,显著优于常规CAR-T细胞(BBz-CAR),在白血病异种移植小鼠模型中,在不同剂量的T细胞治疗下, STAR-T细胞比BBz-CAR-T细胞展示出更强的肿瘤清除,并无显著的组织损伤情况;随后,进一步偶联不同共刺激分子至STAR结构进行优化以增强STAR-T细胞的增殖能力,细胞水平结果显示STAR偶联OX40 (STAR-OX40)后,在靶细胞的刺激下能显著增加IL-2的分泌以及增殖水平,该结构显著优于其他结构 (如:STAR-4-1BB, STAR-CD28, STAR-CD27, STAR-ICOS), 此外,其在靶细胞与外周血细胞共培养体系下,分泌出更低的细胞因子风暴(CRS)相关的细胞因子。不同的白血病异种移植小鼠模型结果同样显示STAR-OX40-T细胞具有更好的肿瘤清除效果和增殖效果,并且能够有效的抑制肿瘤的复发效果。根据细胞水平和动物水平的研究,STAR-OX40结构用于I期临床研究。
临床研究结果
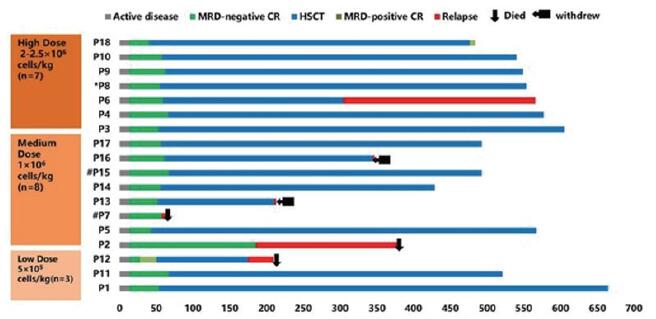
该I期临床试验中,中位随访时间为507天(范围:63-665天)。治疗前中位骨髓原始细胞水平为15.3% (范围0.5% - 90.5%),1例为移植后复发患者,2例有中枢神经系统白血病(CNSL)。18例患者均接受中位剂量为1×106 / kg的STAR-OX40-T细胞的单次输注:低剂量组(5×105 / kg,n = 3),中剂量组(1×106 / kg,n = 8)和高剂量组(2~2.5×106 / kg,n = 7)。从采集到输注STAR-OX40-T细胞的中位时间为9天(7-13天)。中位转染效率为57.4%。STAR-OX40-T细胞输注后两周评估,100%(n=18)的患者获得完全缓解(CR)且微小残留病(MRD)阴性, 在30天后评估,CR率为100%,有1例患者出现了原始细胞0.09%的MRD阳性。在 STAR-OX40-T 细胞回输后中位 57.5 天(范围:40-67 天),16/18 (88.9%) 的CR患者(15 例 MRD 阴性,1 例MRD 阳性)选择接受了巩固性的 allo-HSCT。在中位随访 549 天(范围:433- 665 天)后,11例患者仍保持 MRD 阴性 CR,1例在第 477 天变为 MRD 阳性,其他三例分别在第 211 天、第 305 天和第 345 天出现复发,1例在第 210 天死亡。在 allo-HSCT 后,7 例患者出现急性 GVHD(4 例I 级、1 例II 级、1 例 III 级和 1 例 IV 级),3 例患者出现局限于皮肤或肺部的轻度慢性 GVHD。在未接受巩固allo-HSCT 的两例患者中,一例在第 58 天复发并在第 63 天死亡。该患者的治疗前 BM 原始细胞水平比例为 90%,BCR-ABL1 (P210) 阳性且患有CNSL。另一例在第 186 天复发,并在第 378 天死于复发。整体来看,总共有6例患者在接受 STAR-OX40-T 细胞治疗后复发。出现复发时,4 例患者为 CD19+,2 例患者为 CD19-。
关于不良反应方面,只有55.6%(n=10)的患者出现了1-2级轻度的细胞因子释放综合征CRS,其中8例患者为1级CRS,2例为2级CRS。另外,2例患者出现3级神经毒性反应。
STAR-OX-T 细胞输注后的表现
输注STAR-T细胞后,通过qPCR和流式监测外周血中的CD19 STAR-OX40-T细胞。无论输注剂量如何,STAR-OX40-T细胞都显示出高的体内细胞扩增和持久性。qPCR显示达到峰值水平的中位时间为8.5天 (范围:4-10天),中位扩增倍数为 4.9×104copies/μ 外周血基因组DNA。流式结果显示中位STAR-OX40-T /CD3峰值为13.87% (范围: 1.42%-88.1%),而且有患者在输注6个月后依然能检测到STAR-OX40-T细胞水平。
研究结论
此临床前研究证明了STAR-T细胞在临床前研究及动物模型中在T细胞活化能力、细胞因子产生能力和抗肿瘤疗效方面比常规CAR-T细胞优越。首次用在人身上的I期临床研究证明了STAR-OX40-T在治疗CD19 + R / R B-ALL中的技术可行性、临床安全性和有效性。输注后可达到较高的CR率,且毒性较低。但仍需对这些患者进行长期观察,并进行更大范围的患者研究。
无需额外进行"自然选择" ,首次人体I期临床试验
CD7在T-ALL/LBL T细胞表面高度表达,是潜在的CAR-T治疗靶点。靶向CD7的免疫疗法可能会受到T细胞自相残杀机制(fratricide)的影响。因此,在既往研究中曾采用CRISPR/Cas9基因编辑技术和蛋白沉默表达技术生产靶向CD7的CAR-T细胞。但是,基因编辑技术会使得CD7 CAR-T细胞的生产成本增加。此外,使用患者自体T细胞制造CD7 CAR-T细胞仍然具有一定难度。虽然供者来源或通用型CD7 CAR-T是一种选择,但寻找合适的供体、异体CAR-T在体内扩增能力及持续时间等问题仍有待解决。
靶向CD7 的CAR-T 细胞功能比较
针对这些难题,2022年5月2日,陆道培医学团队另一篇高水平研究论文值得注意。
陆道培陆佩华教授团队、河北森朗生物科技有限公司李建强教授团队、北京大学人民医院黄晓军教授合作在血液科 国际权威期刊Blood发表了题为Naturally Selected CD7 CAR-T Therapy without Genetic Manipulations for T-ALL/LBL: First-in-human Phase I Clinical Trial 的研究论文。 研究团队使用了森朗生物研发的患者或供者来源的,无需额外进行CD7基因编辑或蛋白质表达阻断的"自然选择(Naturally Selected)"CD7 CAR-T细胞(NS7CAR)的新产品,并在1项针对T-ALL/LBL患者的1期临床试验中首次探索了NS7CAR疗法在人体内的安全性和有效性。
临床前研究
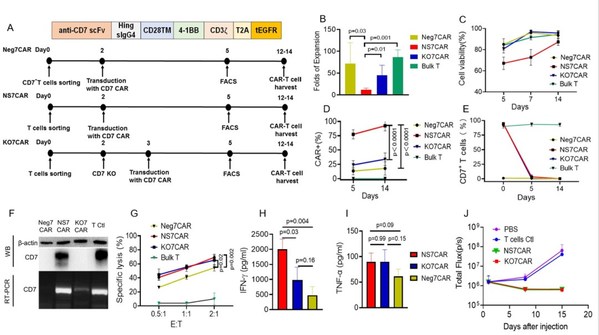
研究者使用三种不同的方法制造了靶向CD7的CAR-T细胞并比较它们的功能:1)NS7CAR:通过用7CAR转导总T细胞,然后对其进行"自然选择"的细胞培养方式获得;2)Neg7CAR:由天然存在的CD7阴性T细胞(占CD3+T细胞的3%-10%)用7CAR进行纯化和转导后进行生产;3)KO7CAR:通过将7CAR转导到使用CRISPR/Cas9RNP敲除CD7基因的总T细胞进行制造。
在2周的培养期间内,NS7CAR的细胞扩增倍数显著低于Neg7CAR和KO7CAR的扩增倍数;然而,有87.3%的NS7CAR是活细胞,使得进一步研究成为可能。在收获时,NS7CAR组中平均92.4%的T细胞表达7CAR分子,显著高于Neg7CAR或KO7CAR(p<0.0001)。在7CAR慢病毒转导三天后,NS7CAR组中的T细胞发生了从CD7+CAR-到CD7-CAR+的快速而显著的表型转变。
NS7CAR-T 细胞输注后表现
一个有趣的发现是,尽管NS7CAR组中的T细胞在体外培养后用流式未检测到CD7的表面表达,但使用RT-PCR和WesternBlot检测到了显著的CD7mRNA和蛋白质的表达。与此同时,在Neg7CAR或KO7CAR细胞中未观察到CD7mRNA或蛋白质表达。这些结果表明,尽管NS7CAR表达CD7mRNA和蛋白质,但它们在免疫学上是CD7阴性的,并由于CD7CAR的抗原隐蔽/细胞内隔离作用而逃脱了自相残杀的细胞杀伤机制。这一点在随后的临床研究中,在CAR-T回输后第28天检测到患者体内NS7CAR中CD7mRNA的表达持续存在而被进一步证实。此外,相比Neg7CAR和KO7CAR,NS7CAR包含较多的CD8+亚群和中央记忆表型亚群。
在体外抗白血病实验中,NS7CAR和KO7CAR对CCRF-CEM细胞均表现出相当的细胞毒性,并释放高水平的IFN-γ和TNF-α,但Neg7CAR细胞的相应数值较低。在动物实验中,在CAR-T注射后的前两周内,NS7CAR和KO7CAR均可显著降低小鼠模型中的白血病负担。这些数据证明了无需额外的基因编辑,直接由7CAR转导的总T细胞产生有效的CD7CAR-T的可行性。因此,陆道培医疗团队在1期临床试验中使用NS7CAR-T细胞,进一步探索其有效性和安全性。
临床研究
研究设计
本研究是1项开放、单臂的1期临床研究,目的是评估NS7CAR对CD7+R/R T-ALL或T-LBL患者的安全性和疗效。入组标准包括年龄在2至65岁之间的患者,既往至少接受过两线治疗后失败,且CD7表达≥80%的患者。在NS7CAR输注后的第28天后,根据医生的考量和患者的意愿,允许进行巩固性异体造血干细胞移植。
患者基线数据
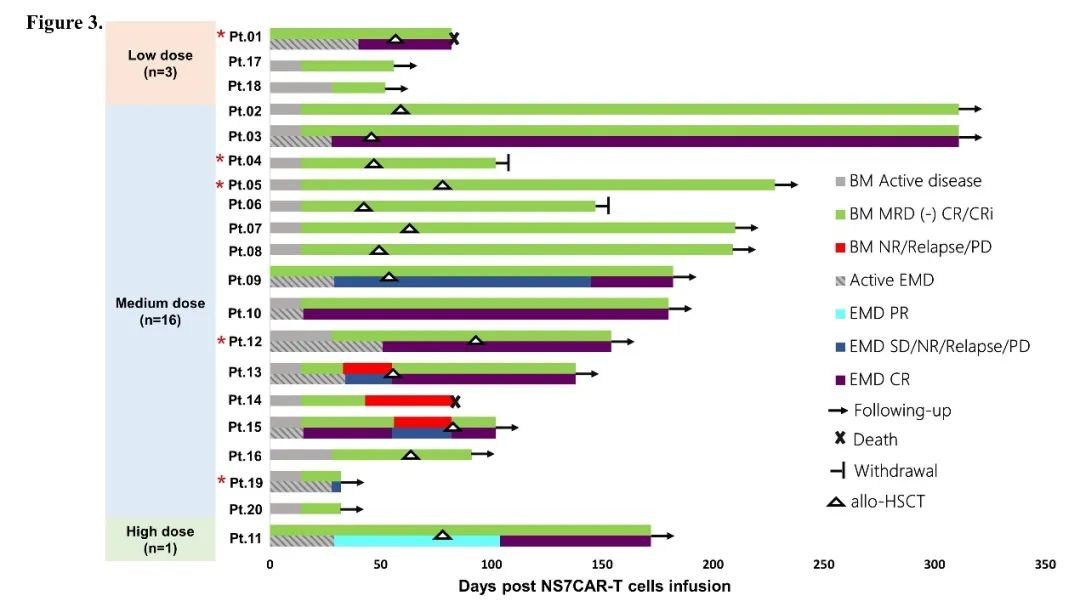
此次临床试验,共入组和回输20名复发或难治性(R/R) T-ALL/T-LBL患者,其中包含14名R/R T-ALL患者及6名R/R T-LBL患者。3名患者为Ph阳性或ETP-ALL高危亚型;11名患者存在高危突变或基因融合。5名患者在入组前接受过移植。患者接受了中位数为4.5线的治疗。入组时,17名患者的骨髓肿瘤细胞比例中位数为21.49%;有3名T-LBL患者髓内未见肿瘤细胞。分别有5位T-LBL和4位T-ALL患者有髓外病灶,其中3名有中枢受累。
临床产品制备及回输
研究应用了来源于患者或其移植供者的NS7CAR产品。对于未接受过异基因移植的患者,使用自体CAR-T细胞 ;对于入组时为移植后复发状态的患者,在对患者进行综合评估后确定使用患者自体或移植供者来源的CAR-T细胞。所有患者的NS7CAR产品均成功制备(自体来源,n=18;供者来源,n=2),中位转染效率为95.10%。NS7CAR产品有更多的CD8+亚群,中位CD4/CD8比例为0.42。在Day0,分别3、16和1名患者接受了低剂量(0.5×106/kg)、中剂量(1-1.5×106/kg)或高剂量(2×106/kg)的单次NS7CAR回输。
NS7CAR 回输后CD7+ 细胞表现
疗效及安全性
NS7CAR展现出了良好的安全性和耐受性。1名患者未出现CRS;18名患者的CRS≤2级,仅有一名患者出现3级CRS。2名患者发生1级ICANS。
同时,NS7CAR在临床试验中展现了令人振奋的好疗效。在Day28时,16/17(94.12%)的骨髓受累患者实现了MRD阴性完全缓解;3名仅有髓外病灶的T-LBL患者也继续保持了髓内CRi的状态。在9名有髓外病灶的患者中,5名在中位时间29天时达到髓外CR。两名有巨大纵隔肿物(>7cm)的患者在第29天分别达到髓外部分缓解(PR)和疾病稳定(SD),其中PR患者在第104天时,其髓外病灶进一步缩小。两名有中枢神经系统浸润的患者也分别在第15天和第28天达到CR。
至研究截止日期(2021年10月25日),患者的中位随访时间为142.5天,最长达311天。6/20名患者在CAR-T细胞回输后未接受额外的抗白血病治疗或移植,其中4人在54天的中位时间保持无疾病进展。在回输后中位时间57.5天,10名CR患者接受了巩固性桥接移植;移植后中位随访时间为210天,7/10名CR患者在移植后保持MRD阴性并持续生存。两名患者因个人原因出组,出组时均处于CR。一名患者进行了二次移植,发展为3级aGvHD,随后去世。有4名未达到CR或CR后复发的患者接受了挽救性移植并全部达到CR。
NS7CAR的细胞动力学
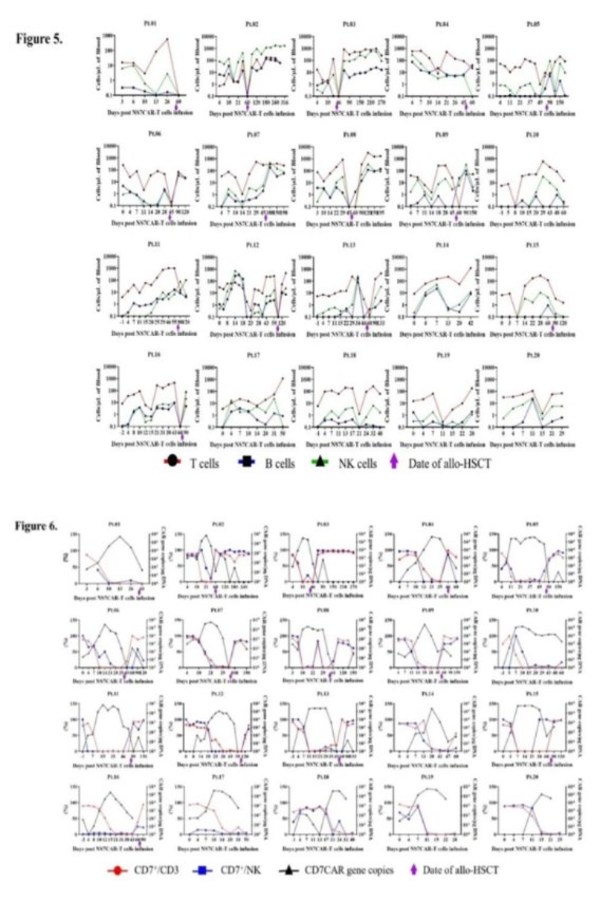
NS7CAR扩增起始于回输后中位数4.5天。CAR中位峰值拷贝数为1.37×105copies/μg DNA,达到峰值的中位时间为19天。在末次随访时,NS7CAR+DNA中位持续时间为90天;在移植后中位时间39.5天,12/14名患者仍可通过qPCR检测到水平较低的NS7CAR+DNA。对于未桥接移植的6名患者,CAR-T细胞在末次随访中仍可检测到,中位持续时间为48.5天。用流式检测的NS7CAR中位峰值比例为67.76%,最高比例达84.71%;中位峰值时间为17天。
NS7CAR回输后,患者外周血中恶性和正常CD7+细胞的最显著减少发生在回输后中位时间第7天。在CAR-T扩增高峰,每位患者的T/B/NK细胞(不包括CAR+ 和白血病T细胞)的绝对数量均显示出不同程度的短暂下降。NS7CAR迅速消灭了CD7+细胞,并主要保留了CD7阴性细胞亚群。T/B/NK细胞随后恢复到基线水平,但就如所预期的,在移植后不久出现下降。在移植后,正常的CD7+T细胞和NK细胞得到充分恢复。
总结
该研究揭示了通过"自然选择"机制生产靶向CD7 CAR-T细胞的方法(NS7CAR)。研究者发现,虽然流式无法检测到NS7CAR-T细胞表面上的CD7分子,但NS7CAR-T细胞继续表达CD7mRNA和蛋白质的水平虽然稍低,但与正常对照T细胞中的水平是可比的。研究认为,NS7CAR-T细胞的CD7分子很可能被CD7CAR抗原掩盖或在胞内隔离,大大减少了NS7CAR-T的表面CD7抗原,避免了CAR-T细胞之间的大量自相残杀。不能排除在体外"自然选择"过程中,少部分NS7CAR-T细胞从自相残杀中出现的可能性。这使得NS7CAR-T与真正的CD7阴性的Neg7CAR-T或KO7CAR-T细胞形成对比。研究者提出,许多NS7CAR-T细胞本身并不是CD7阴性,而是功能性CD7阴性。
因此,研究者提出假设:由于CAR信号可能需要蛋白质复合物形成,CAR-T细胞通过NS7CAR-T细胞表面的游离CD7CAR与靶向T细胞上表达的CD7之间的相互作用被激活,而胞内CD7-CD7CAR复合物不能激活T细胞。与Neg7CAR和KO7CAR细胞相比,细胞内CD7CAR-CD7相互作用是否导致CAR信号减弱,并导致NS7CAR细胞体外扩增程度降低仍待确定。其次,自相残杀是否在NS7CAR减少扩增中发挥了作用还有待进一步研究。
在NS7CAR中,明显存在更多的CD8+中央记忆CAR-T细胞,这种CD8偏向性可能提供更持久的疾病控制。由于NS7CAR的产生不涉及额外的基因编辑,避免了脱靶效应的潜在风险。因此,NS7CAR的生物学特性和其生产的便捷十分有利于其临床应用。
迄今为止,针对T细胞恶性血液肿瘤的靶向CD7 的CAR-T疗法仅有有限的临床试验和病例报告。
NS7CAR可由患者或供者的外周血制备,中位转染率大于95%,且细胞活性率约90%。由T系恶性血液肿瘤患者制备的自体CAR-T细胞的主要安全顾虑是细胞终产品中的恶性细胞污染。根据每个患者循环肿瘤细胞的表型,使用CD3或CD4/CD8选择加上NS7CAR的体外 "自然选择 "以及强大的抗白血病活性,可以成功地排除NS7CAR制备中的恶性细胞。
在该临床试验中,几乎所有患者在第28天时都达到了MRD阴性的CR。大部分有髓外病灶的患者,包括中枢神经系统白血病患者或弥漫性髓外受累的患者,也都能达到髓外CR。两名有巨大纵膈肿块的患者分别达到了PR和SD。对于有巨大肿块的患者来说,可能需要更长的时间及联合治疗来实现CR,因为根据PET-CT评估,处于PR的患者在第104天发现有进一步的临床改善。
入组该临床试验的患者曾接受了大量的既往治疗。鉴于CD19 CAR-T治疗的B-ALL患者复发率较高,而且T-ALL/LBL比一般B-ALL更具侵略性,该研究允许在缓解后进行巩固性异基因造血干细胞移植。共有10名骨髓和髓外CR患者进行了巩固性异基因造血干细胞移植,这可能限制对于NS7CAR-T单药治疗的持续性的评估。尽管如此,在中位随访时间超过4.5个月(最长10个月)的情况下,NS7CAR回输后再进行异基因造血干细胞移植组没有观察到复发现象。在6名没有接受移植的CR患者中,有4名在最后一次随访时仍保持CR(中位时间1.5个月,最长6个月)。然而,在一些未达到CR或复发的患者中,观察到CD7靶点丢失。
STIL-TAL1融合基因与较高的复发率和较差的预后有关,发生在高达约25%的T-ALL患者中。在这一研究中,所有3名STIL-TAL1融合基因的患者预后都较差,有1名NR和2名早期复发,表明单独使用CAR-T疗法可能无法扭转其临床结局。一旦这类患者从CAR-T中获得CR,应在治疗过程的早期考虑进行移植。
NS7CAR-T细胞的扩增在中位第19天达到峰值,截至最后一次随访时,可检测到NS7CAR-T细胞持续存在长达195天。12/14名患者在移植后中位随访时间1.2个月(最长4.9个月)时,仍可通过qPCR检测到低水平的NS7CAR-T。
NS7CAR表现出卓越的安全性,在大多数患者中只有轻微的CRS,没有严重的神经毒性。在该临床研究方案中,早期应用托珠单抗干预管理,有可能降低严重CRS的发生。这种早期干预和管理可能在减少CRS方面发挥了作用。
两名曾有异基因造血干细胞移植史的患者在回输时使用了来自移植供者的CAR-T细胞,其中一位出现了轻微的皮肤排异反应。因此,应特别关注此类患者。14名患者中有7名接受了后续的异基因造血干细胞移植,包括其中2名第二次移植的患者出现了GvHD。虽然在这7名回输后出现GvHD的患者中仍可检测到极低水平的CAR-T细胞,但是不太可能是导致GvHD的原因。
在该研究中,NS7CAR在体外和体内均表现出强大的抗肿瘤作用。NS7CAR的首次人体临床试验表明,无需额外的基因编辑即可防止CD7表达,并成功生产NS7CAR-T细胞。总体而言,NS7CAR对治疗R/R T-ALL/LBL是安全且高效的。
作者:John Xie
来源:荣格-《国际医药商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。