荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
纤连蛋白在皮肤的健康和修复过程中具有重要的功效,能够促进细胞的黏附和迁移,促进伤口的修复,维持细胞外基质的结构和功能,是一种重要的功效性成分。本研究证明利用合成生物学方法合成的带有整联蛋白结合位点RGD的纤连蛋白片段,不仅在细胞黏附伤口愈合中有优异的功效,也具有显著促进不同类型胶原蛋白合成的功效,在抵抗皮肤衰老中也能起到非常重要的作用,或者会是皮肤衰老相关的重要活性成分。
纤连蛋白是细胞外基质的一个组成部分,可以跟细胞,胶原蛋白,蛋白聚糖和其他大分子结合,在细胞黏附和伸展,细胞迁移,止血和血栓形成,细胞形态等方面起重要的作用[1-5]。纤连蛋白通常以二聚体的形式存在,由两条几乎一样的大约250 kDa的单体通过C端的二硫键共价结合。每一条单链含有3个重复单位,也可叫纤连蛋白重复单位。纤连蛋白包含12个含约40个氨基酸残基的I型重复单位,其中包含两个二硫键;2个含约60个氨基酸残基的II型重复单位,包含两个链内二硫键;15-17个约含90个氨基酸残基的III型重复单位,没有任何二硫键。尽管人纤连蛋白分子是单一基因的产物,但是所产生的蛋白可以是多种形态的,因为一条纤连蛋白的mRNA前体可以有多种剪切形式,能够产生多达20种不同的纤连蛋白变体。这些变体具有不同的细胞黏附特性,不同的受体结合能力,不同的溶解特性,使得细胞能够根据发育阶段的不同,所在组织的不同从而精确的协调细胞外基质的成分[6-7] 。
纤连蛋白是血浆中丰富的可溶性成分(300 µg/ml)和其他体液的可溶性成分,也是不溶性细胞外基质的一部分。因此纤连蛋白可分为可溶的血浆纤连蛋白(pFN)和不可溶的细胞纤连蛋白(cFN)。血浆纤连蛋白主要由肝细胞合成,剪切形式相对单一。而细胞纤连蛋白包含更多的各种各样的剪切形式,产生各种具有细胞特异性和组织特异性的产物。因此尽管血浆纤连蛋白在血液中循坏,但大部分目前报道的纤连蛋白的功效都来自于不可溶的细胞纤连蛋白。纤连蛋白是大型的糖蛋白,根据细胞来源的不同,含有4-9%的碳。纤连蛋白糖基化的作用还不十分清楚,但是可能与稳定纤连蛋白不被水解,调整与其他基质的亲和力等方面相关。
纤连蛋白是多种整联蛋白受体的配体。整联蛋白(integrin)又称整合素,整联蛋白属整合蛋白家族,是一类普遍存在于脊椎动物细胞表面,依赖于Ca2+或Mg2+的异亲型细胞黏附分子,介导细胞和细胞之间以及细胞和细胞外基质之间的相互识别和粘附,具有联系细胞外部作用与细胞内部结构的作用。非常多的整联蛋白可以与纤连蛋白结合,包括α5β1,其识别位点RGD,位于纤连蛋白的第10个III型重复单位。而位于第9个III 型重复单位的氨基酸片段PHSRN,对整联蛋白与纤连蛋白的结合具有促进作用。纤连蛋白除了与细胞表面的整联蛋白结合起作用外,也可以与一些重要的生物因子如肝素,胶原蛋白/明胶,和纤维蛋白相结合,从而起到相应的生物学功能[8-10]。
我们做了一项研究,结果发现,利用毕赤酵母生物合成的一段含有整联蛋白受体的结合位点RGD的纤连蛋白片段,不仅具有促进细胞黏附和伤口愈合改善敏感肌的功效,还具有非常显著的促进成纤维细胞合成多种胶原蛋白表达的功效,如胶原蛋白III,胶原蛋白V,胶原蛋白XVIII。下文将对实验结果进行描述并对结果进行讨论。
实验方法
抗衰基因的促进作用
人原代真皮成纤维细胞在37℃、含5%CO2、饱和湿度的培养箱中培养。待细胞生长至80%以上汇合后消化接种于12孔板,并继续培养48h用于测试。实验当天选取合适的样品浓度处理细胞24h,弃上清液后,用预冷的磷酸缓冲液(PBS)每孔1mL清洗2次,随即用RNA抽提试剂制备细胞裂解液。集齐裂解液样本后统一提取细胞总RNA,反转录为cDNA。后利用实时荧光定量PCR检测胶原蛋白相关基因表达水平,所得结果以2- ΔΔCt法进行分析定量。得到各组细胞的基因表达量。PCR测试的引物序列如下图所示。
PCR引物:
COL3A1 F: TGGTCTGCAAGGAATGCCTGGA
R: TCTTTCCCTGGGACACCATCAG
COL5A1 F: GGAGATGATGGTCCCAAAGGCA
R: CCATCATCTCCTTTGTCACCAGG
COL18A1 F: GGAGAGATTGGCTTTCCTGGAC
R: CCTCATGCCAAATCCAAGGCTG
统计方法: 所有结果以Mean±SD表示,计量资料差异比较采用unpaired t检验,P<0.05视为差异有统计学意义。图表中*代表P<0.05,**代表P<0.01,***代表P<0.001。
结果与讨论
众所周知,皮肤衰老与胶原蛋白和弹性蛋白等蛋白的减少直接相关,也跟因水解酶活性增加而导致的蛋白的降解有关。本实验中我们就纤连蛋白对几类胶原蛋白的合成的促进作用进行了分析,发现我们利用生物合成技术合成的含有RGD整联蛋白结合位点的纤连蛋白片段具有促进成纤维细胞合成胶原蛋白III,胶原蛋白V和胶原蛋白XVIII的作用。胶原蛋白是细胞外基质的重要组成部分,给组织提供机械稳定性,弹性和韧性[11]。胶原蛋白至少有28种不同的类型,每一种胶原蛋白都具有独特的性状和功能,如纤维性胶原,基底膜胶原,不完整的三螺旋纤维连接胶原,跨膜胶原等[12] 。本文中提到三种不同的胶原蛋白,胶原蛋白III,胶原蛋白V和胶原蛋白XVIII,在皮肤中的分布和功效各有不同。
胶原蛋白III 是人体上第二丰富的胶原蛋白[13],首次发现和记录在1971年[14]是一种重要的结构蛋白,也是重要的纤维性胶原蛋白[15],在人体中约占总胶原蛋白的5-20% [16]。COL3A1缺失的人有可能得“血管型埃勒斯-丹洛斯综合症",即会有血管和器官破裂的致命性风险,伴随着肌肉骨骼蜕变等早衰症状[17-18]。胶原蛋白III也可通过跟细胞受体整联蛋白结合,起到促进细胞黏附,迁移,增殖和分化的作用[19]。
本研究发现,包含整联蛋白结合位点RGD的纤连蛋白片段具有很好的促进胶原蛋白III基因表达的功效(见图1),在低浓度如3ppm,6ppm的纤连蛋白对胶原蛋白III的促进具有浓度依存性,但是15ppm的条件下,对胶原蛋白III的促进作用就明显减缓,也说明该片段具有很好的调控相应基因表达水平的能力,达到生物稳定性的状态。
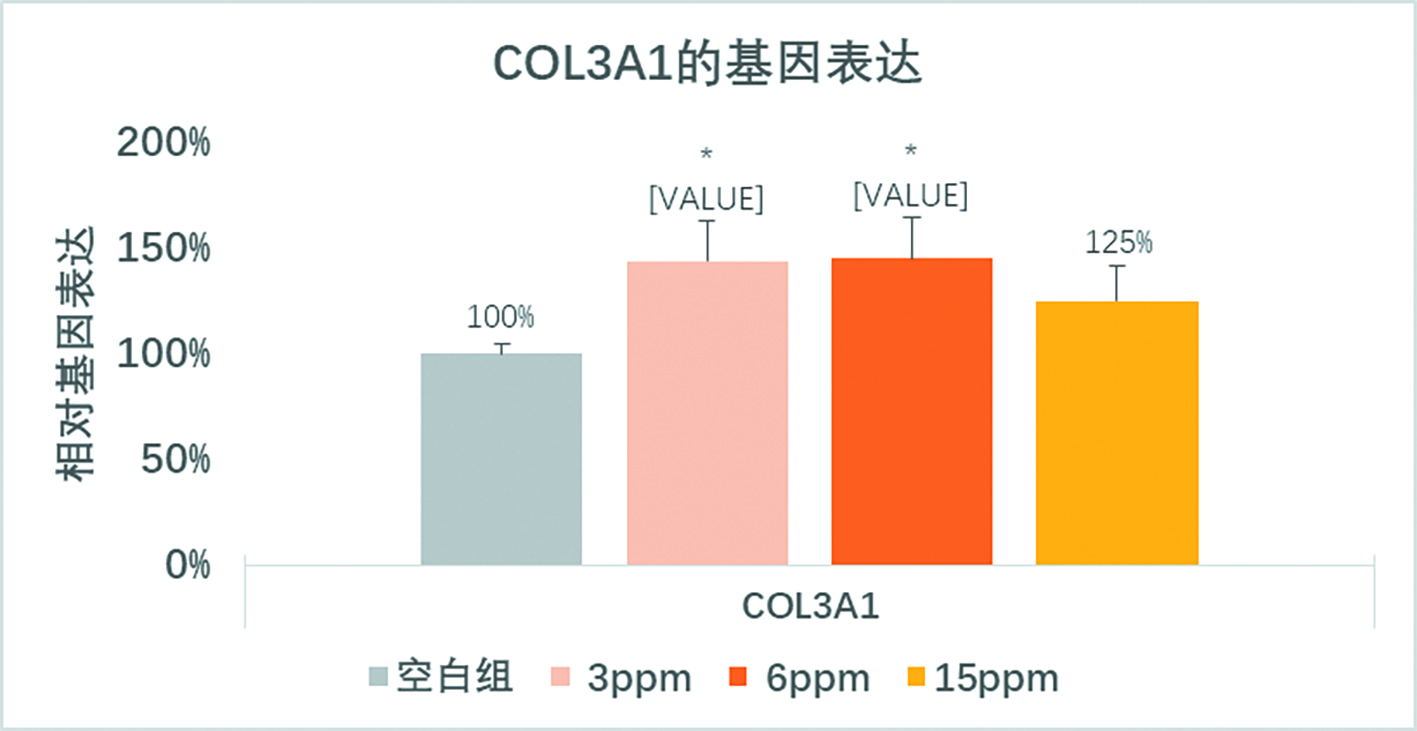
图1 不同浓度的纤连蛋白片段促进成纤维细胞中胶原蛋白3A1的基因表达。在低浓度3ppm和6ppm是对基因的促进作用呈浓度依存性,到较高浓度15ppm时,作用效果有所减少,证明该纤连蛋白片段有最佳的浓度促进胶原蛋白3A1基因的表达。
胶原蛋白V首次发现在1976年,在人的胎盘和含有丰富基底膜的器官中[20-21], 后来发现胶原蛋白V广泛分布在结缔组织中。胶原蛋白V可以调控胶原蛋白I和III的纤维生成,胶原蛋白V也是一种纤维性蛋白,但是功能和结构与胶原蛋白I和III完全不同[22]。Jeffery等人于1996年发现胶原蛋白V的减少,会导致异常大直径的胶原蛋白纤维的生成,说明胶原蛋白V在小直径的胶原蛋白纤维组装中的重要性[23]。
本研究发现,包含RGD整联蛋白结合位点的纤连蛋白片段可以促进胶原蛋白V的表达,并且在低浓度下具有浓度依存性,随着浓度的增加,又有下降的趋势(见图1、2,15ppm)。说明了该纤连蛋白片段能促进胶原蛋白V的表达,又不会无限促进其表达,保持生物安全性。
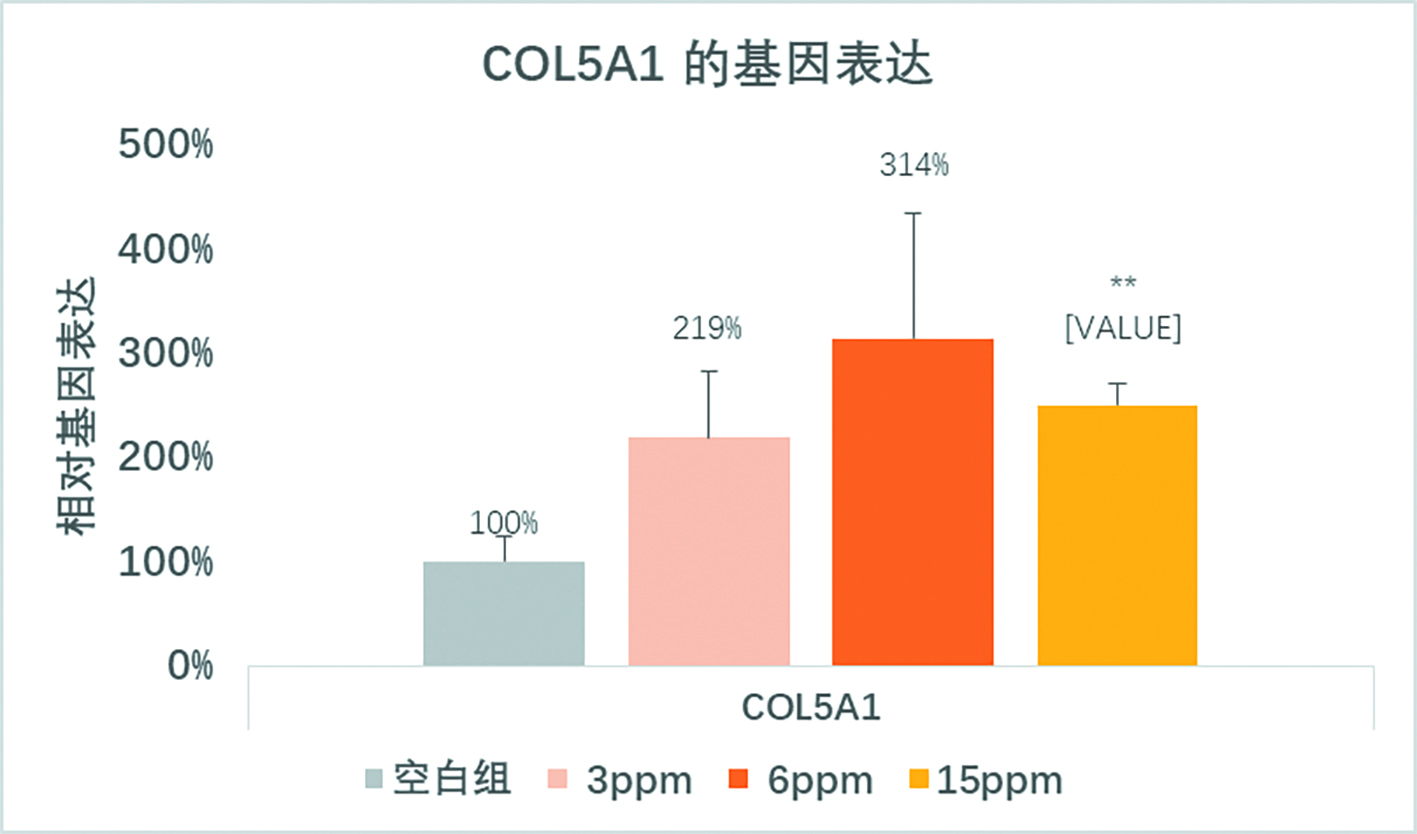
图2 不同浓度的纤连蛋白片段促进成纤维细胞中胶原蛋白5A1的基因表达。在低浓度3ppm和6ppm是对基因的促进作用呈浓度依存性,在较高浓度15ppm时,作用效果有所减缓,证明该纤连蛋白片段有最佳的浓度促进胶原蛋白5A1基因的表达。
胶原蛋白XVIII 是第一个被发现具有硫酸乙酰肝素侧链的胶原蛋白,与胶原蛋白XV一起被划分为新的胶原蛋白亚型,称为Multiplexin [24]。胶原蛋白XVIII比较受人关注是因为其C端有一段18KDa的抗血管形成多肽具有抑制肿瘤的效果,称作Endostatin 内皮抑制素[25]。胶原蛋白XVIII是一个糖蛋白,几乎一半的分子量来自于硫酸乙酰肝素侧链,而且胶原蛋白XVIII 是几乎所有胚胎期和成年期基底膜的组成部分。胶原蛋白XVIII基因的缺失会导致小鼠和人的视力逐渐衰退,并且随着年龄的增加眼睛的形状会变得不正常。
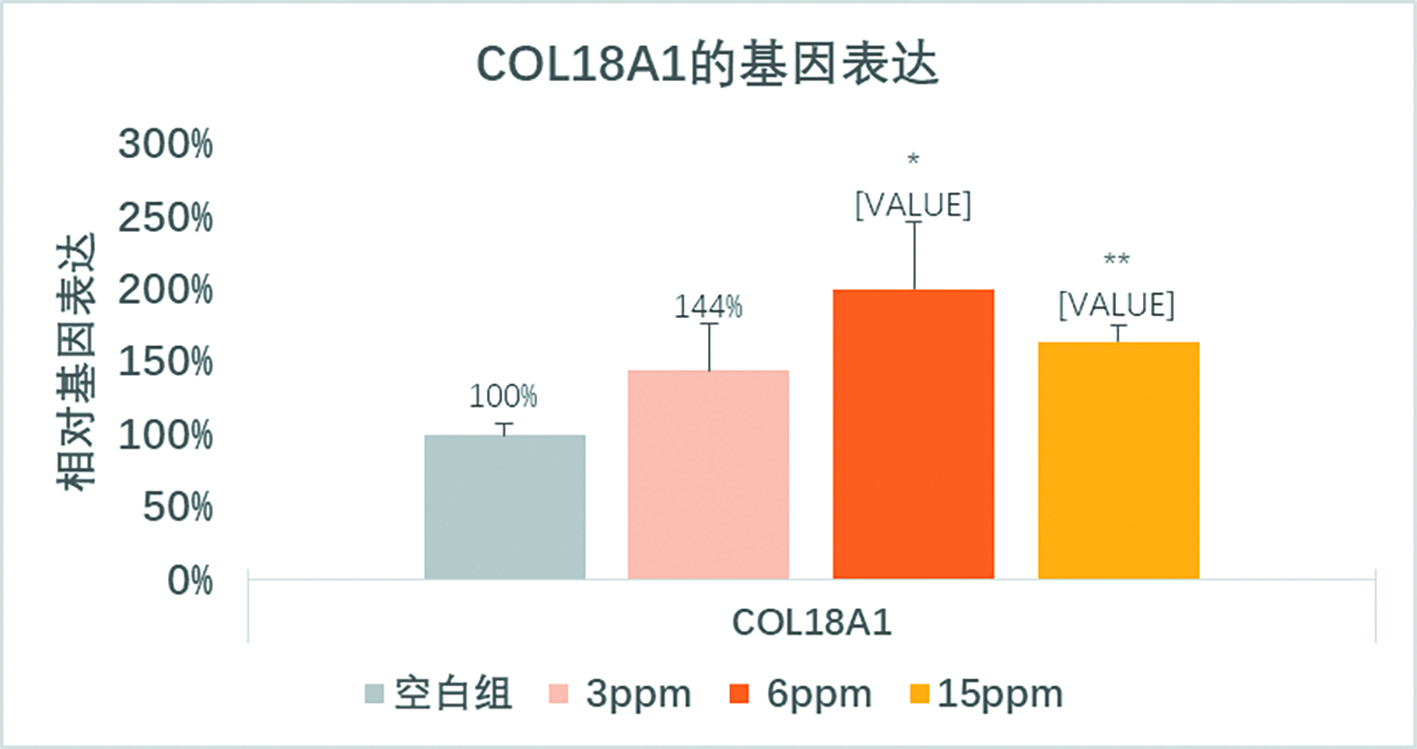
图3 不同浓度的纤连蛋白片段促进成纤维细胞中胶原蛋白18A1的基因表达。在低浓度3ppm和6ppm是对基因的促进作用呈浓度依存性,而在较高浓度15ppm时,作用效果有所减缓,证明该纤连蛋白片段有最佳的浓度促进胶原蛋白18A1基因的表达。
综上所述,胶原蛋白在维持皮肤的结构和弹性等方面起到重要作用,但是随着年龄的增长,胶原蛋白的合成减少而降解增加,导致皮肤失去弹性,出现皱纹和松弛。本实验研究证明,纤连蛋白片段可以促进几类不同功能的胶原蛋白的合成,如真皮层的胶原蛋白III,具有帮助胶原蛋白I和III更好纤维化的胶原蛋白V,以及分布在各个基底膜上的胶原蛋白XVIII。纤连蛋白片段既可以在其原有的为大家所熟知的伤口愈合中起功效,同时又可以起到皮肤抗衰老的功效,可以作为一种多功效的活性成分被广泛应用在个护领域中。
作者:邵奇妙,赵娜
来源:青然新护(杭州)科技有限公司
参考文献:
[1] Yamada K M. Cell surface interactions with extracellular materials[J]. Annu.Rev. Biochem, 1983,52:761-799.
[2] Hynes R O. Fibronectin[J]. PubMed, 1986, 254(6):42-51.
[3] Mcdonald J A. extracellular matrix assembly[J]. Annu. Rev. Cell Biol, 1988, 4:183-208.
[4] Ruoslahti E. Fibronectin and its receptors[J]. Annu. Rev. Biochem, 1988,57:375-414.
[5] Mosher D F. Fibronectin. Academic Press, Inc., San Diego, 1989, pp.474.
[6] Ffrench C C. Alternative splicing of fibronectin--many different proteins but few different functions[J]. Experimental Cell Research, 1995, 221(2):261-271.
[7] Kosmehl H, Berndt A and Katenkamp D. Molecular variants of fibronectin and laminin: structure, physiological occurrence and histopathological aspects[J]. Virchows Arch, 429:311-322.
[8] Plow E F, Haas T A, Zhang L, Loftus J. and Smith, J. W. Ligand binding to integrins[J]. Biol. Chem., 2000, 275:21785-21788.
[9] Hynes R O. Structure of Fibronectins[J]. Fibronectins, 1990, 113:111-176.
[10] Yamada K M and Clark R A F, Provisional matrix: In The Molecular and Cellular Biology of Wound Repair. Plenum Press, New York,1996, pp. 51-93.
[11] Gelse K, Pschl E, Aigner T. Collagens—structure, function, and biosynthesis[J]. Elsevier, 2003(12):1531-1546.
[12] Fratzl P. Collagen : structure and mechanics[J].Springer US, 2008.
[13] Boudko S P, Engel J, Okuyama K, Mizuno K, Bachinger H P, Schumacher M A. Crystal structure of 533 human type III collagen Gly991-Gly1032 cystine knot-containing peptide shows both 7/2 and 10/3 triple 534 helical symmetries[J]. Biol. Chem., 2008,283 (47):32580-32589.
[14] Miller E J, Epstein E H and Piez K A. Identification of three genetically distinct collagens by cyanogen bromide cleavage of insoluble human skin and cartilage collagen[J]. Biochem Biophys Res Commun, 1971,42:1024–1029.
[15] Prockop D J and Kivirikko K I. Collagens: molecular biology, diseases, and potentials for therapy[J]. Annu Rev Biochem, 1995,64:403–434.
[16] Miller E J. Collagen types: structure, distribution and functions., in: Nimni ME (Ed.), Collagen Vol. 1 CRC Press, Boca Raton, FL, 1988, pp.139–156.
[17] Byers P H, Belmont J, Black J, Backer J D, Frank M, Jeunemaitre X, Johnson D, Pepin M, Robert L, Sanders L, Wheeldon N. Diagnosis, natural history, and management in vascular Ehlers-Danlos syndrome[J]. American Journal of Medical Genetics Part C Seminars in Medical Genetics. 2017,175 (1):40-47.
[18] Malfait F. Vascular aspects of the Ehlers-Danlos Syndromes[J], Matrix Biol. 2018,71-72:380-395.
[19] Kim J K, Xu Y, Xu X, Keene D R, Gurusiddappa S, Liang X, Wary K K and Hook M. A novel binding site in collagen type III for integrins alpha1beta1 and alpha2beta1[J] Biol Chem., 2005, 280:32512–32520.
[20] Burgeson R E, Adli F A, Kaitila II. Fetal membrane collagens: identification of wo new collagen alpha chains[J]. Proc Natl Acad Sci., 1976,73:2579–2583.
[21] Chung E, Rhodes R K, Miller E J. Isolation of three collagenous components of probable basement membrane origin from several tissues[J]. Biochem Biophys Res Commun, 1976,71:1167–1174.
[22] Birk D E, Bruckner P. Collagens, suprastructures and collagen fibril assembly[J]. Springer Berlin Heidelberg, 2011. 1:77–115.
[23] Marchant J K, Hahn R A, Linsenmayer T F. Reduction of Type V Collagen Using a Dominant-negative Strategy Alters the Regulation of Fibrillogenesis and Results in the Loss of Corneal-Specific Fibril Morphology[J]. Journal of Cell Biology, 1996,135(5): 1415-1426.
[24] Muragaki Y, Timmons S, Griffith C M, Oh S P, Fadel B, Quertermous T, Olsen B R. Mouse Col18a1 is expressed in a tissue-specific manner as three alternative variants and is localized in basement membrane zones[J]. Proc. Natl Acad. Sci. 1995, 92(19), 8763-8767.
[25] O'Reilly M S, Boehm T, Shing Y, Fukai N, Vasios G, Lane W S, Flynn E, Birkhead J R, Olsen B R, Folkman J. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth[J]. Cell, 1997, 88(2):277-85.
来源:荣格-《 国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。

