荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
美容化妆的初衷是为了满足人们的社交需求,通过维护皮肤与头发的健康、遮盖瑕疵、改善外貌来提高自信心,增强吸引力,从而提高幸福感等。然而根据《 2022 皮肤屏障白皮书》发布的市场调查结果,导致皮肤健康问题和屏障功能受损的首要原因居然是化妆品的不当使用,这对高速发展的中国化妆品行业不能不说是一个警钟。化妆品应做到安全第一,不带来任何的副作用。正如经皮渗透和皮肤屏障本来就是一对矛盾一样,化妆品在单一维度上的功效的追求并非是无止境的。
目前,在经历了清洁、遮盖瑕疵和体味、改善外观的普通化妆品,到维护皮肤平衡、预防或修护的功能化妆品之后,人们越来越关人与美容产品及行为之间的情感联系。“传统”化妆品的概念将再次被超越,取而代之的是寻找能够实现大脑和皮肤双向沟通的美容产品,情感化妆品或神经化妆品。神经内分泌免疫学的发展已将皮肤护理扩展到神经化妆品,[1]并且这种趋势已转移到头发与头皮护理中。[2,3]
本文将简单地介绍基于心理神经免疫学PNI的心理美容学方法以及基于神经免疫皮肤系统NICS理论提出的神经美容学方法。从神经内分泌免疫学的观点,理解大脑对环境压力(Stress)的应答与头皮组织稳态及毛囊生理调控的关系。进而探讨以大脑-毛囊轴神经内分泌免疫网络为靶标的头皮神经化妆品的发展前景。
心理神经免疫学
1974年罗切斯特大学的罗伯特•阿德 (Robert Ader) 等人研究了老鼠的味觉厌恶反应。给饮用糖精水的老鼠注射引起恶心的免疫抑制剂环磷酰胺,让老鼠形成对糖精的味觉厌恶记忆后,再强制老鼠饮用糖精水,产生的条件反射会抑制老鼠免疫系统活性,导致老鼠因感染它们无法抵抗的细菌和病毒而死亡。这是最早证明神经系统可以影响免疫系统的科学实验之一。[4]1980 年,罗伯特•阿德首次使用了PNI这一术语,解释心理健康与身体健康之间的相互影响。
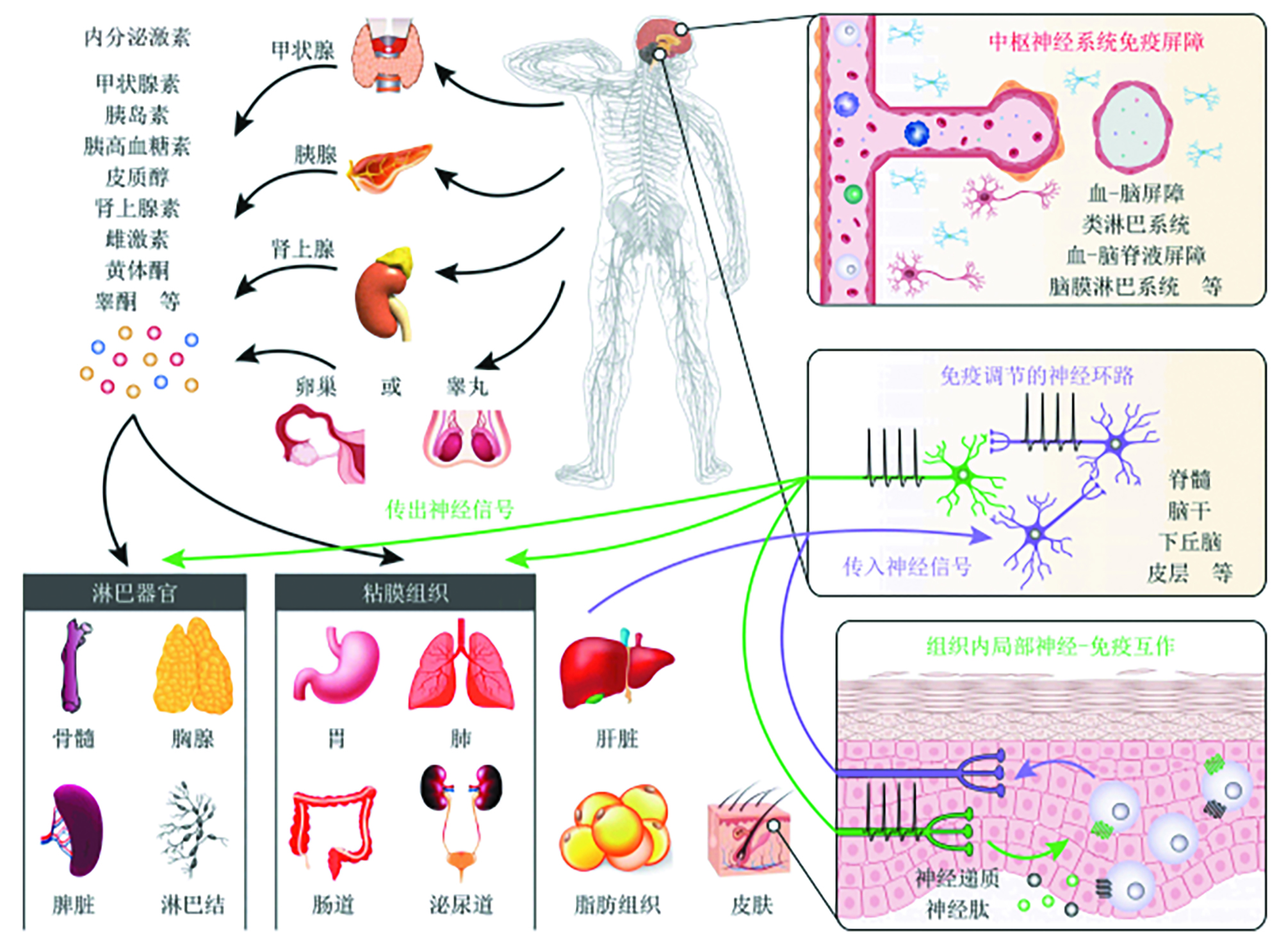
图 1. 人体神经-内分泌-免疫调节网络示意图 [6]
目前,心理神经内分泌免疫学[5]是生命科学中发展最快的领域之一。这是因为神经系统、内分泌系统和免疫系统之间存在频繁的双向信息传递和相互作用,对机体时刻感知内外环境的刺激和维持生理稳态过程中发挥主导作用。(图1) [8]
神经免疫皮肤系统(NICs)理论
随着心理神经内分泌免疫学(PNEI)的发展,人们对大脑和皮肤双向沟通有了更深入的了解。事实上,越来越多的研究结果表明皮肤不仅是机体屏障,也是人体最大的神经内分泌免疫器官[7,8,9,10](如图2所示)。
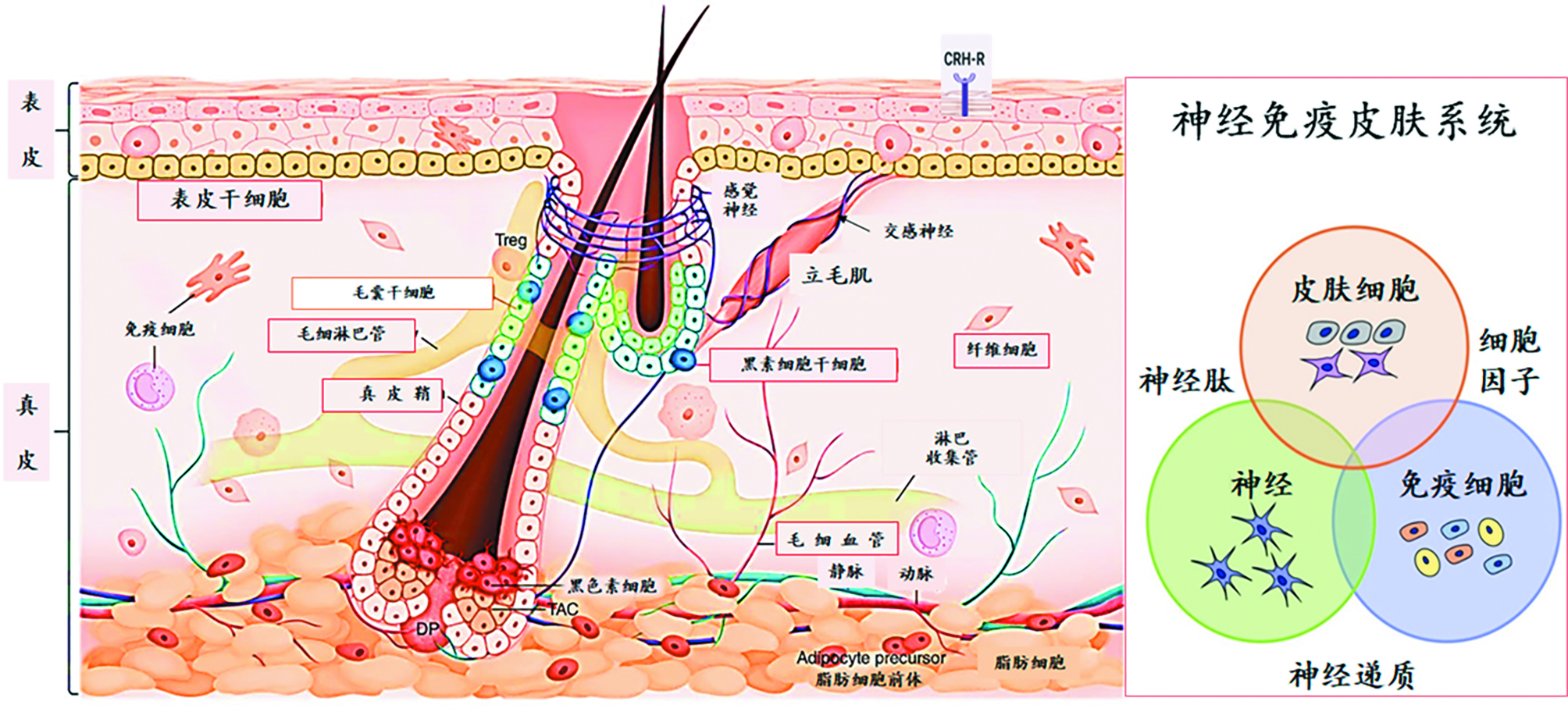
图 2. 皮肤是人体最大的神经内分泌免疫器官 [8,11]
作为一个局部细胞神经免疫单位NICU (Neuro–Immune Cell Unit),[12]神经纤维、皮肤细胞和免疫细胞之间存在大量的细胞接触,并使用相同语言细胞因子和神经递质实现双向沟通。法国布雷斯特大学的洛朗•米塞里(Laurent Misery)教授通过实验确认,提出了神经免疫皮肤系统(NICs)理论[13],并在2002年率先推出了神经美容Neuro-cosmetics[14]的概念。神经化妆品(Neurocosmetics)被定义为 “应用于皮肤、不被吸收、对皮肤神经系统有活性或一般对皮肤介质有影响的产品”。[15] 广义的神经化妆品应该是指含有作用于复杂的神经系统的成分、能够实现大脑和皮肤双向沟通的美容产品。神经化妆品在技术上并非全新,您以前可能在日常美容中使用过神经化妆品,即使没有意识到而已。比如香水就是通过嗅觉系统实现大脑和皮肤双向沟通的美容产品。
重新审视“脑-毛囊轴”:压力抑制毛发生长
长期以来,压力作为脱发的原因一直备受争议,因为缺乏压力引起的毛发生长抑制的可靠证据。 如果心理情绪压力可以影响头发生长,那么必须证明存在“脑-毛囊轴” 的神经内分泌免疫信号通路。 最近,Paus, R. [16]等人通过建立小鼠声波压力模型,触发一系列神经内分泌免疫信号通路,了解神经肽、神经递质、神经营养素的变化和肥大细胞的免疫反应等对小鼠毛发生长的影响。研究结果表明:P 物质 (SP) 和 NGF(神经生长因子)是压力诱导毛发生长抑制作用的关键介质,其调节靶标包括毛囊周围神经源性炎症、心力衰竭角化细胞凋亡、心力衰竭上皮内增殖的抑制以及心力衰竭过早消退(退行期诱导)。 有趣的是,大多数影响可通过使用 SP 受体神经激肽-1 受体 (NK-1) 拮抗剂或 NGF 中和抗体治疗应激小鼠来消除。而且令人惊讶的是,局部使用米诺地尔也可以消除这些影响。 实验证实了“脑-毛囊轴” 神经内分泌免疫信号通路的存在,该信号通路可能被心理情绪和其它压力源所利用,过早地终止毛发的生长。
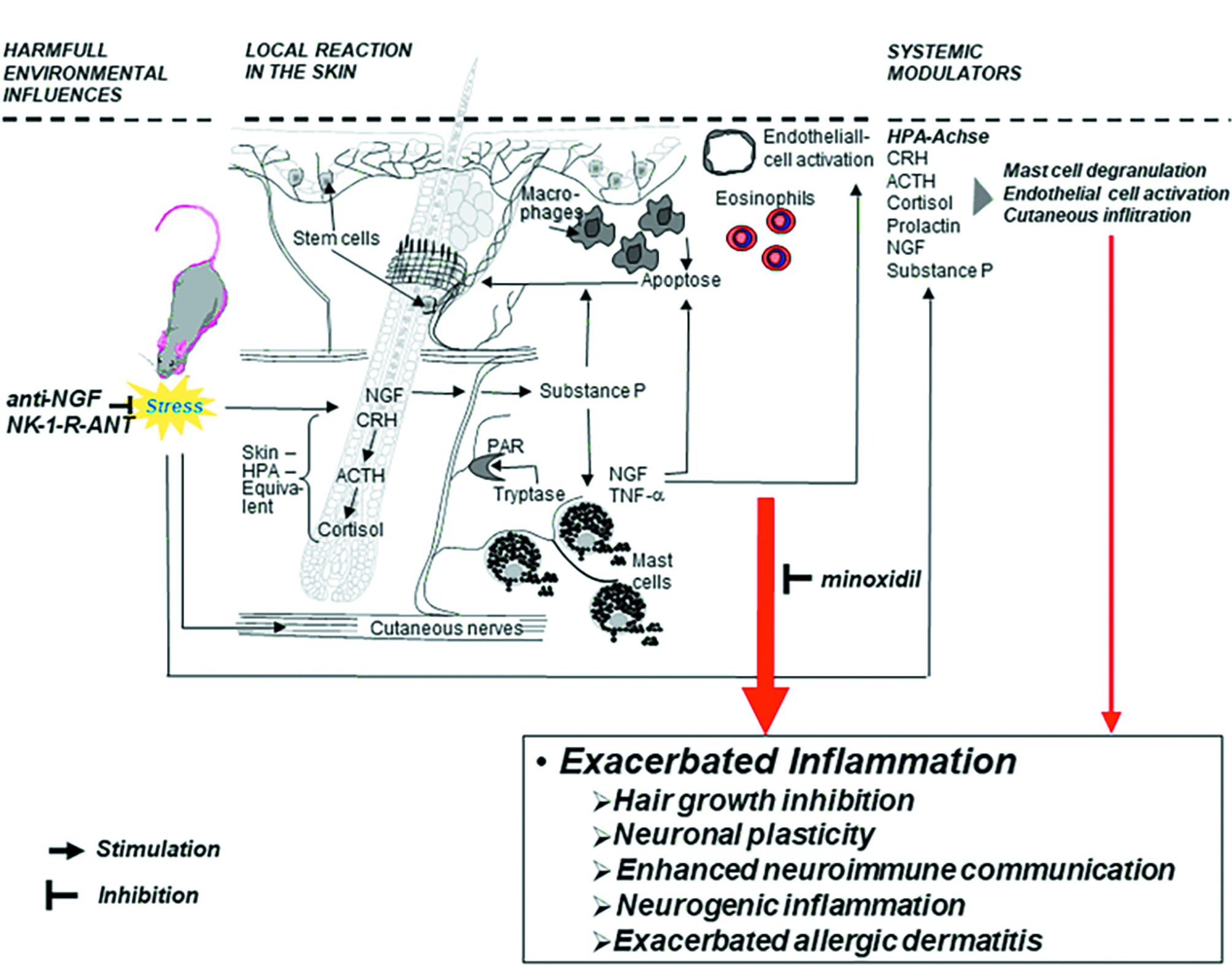
图 3. 毛囊组织的神经内分泌免疫调控 [17]
图3描绘了可能的神经免疫内分泌应激诱导的毛发生长抑制途径。假设压力可以增加全身和局部的 P 物质、神经生长因子 (NGF) 和促肾上腺皮质激素释放激素 (CRH)。 这可能导致肥大细胞和巨噬细胞激活,进而导致类胰蛋白酶释放,随后激活神经纤维上的蛋白酶激活受体(PAR)。 此外,内皮细胞可能被激活并有助于炎症细胞的进一步迁移。肥大细胞和巨噬细胞预计会释放炎症、抗增殖和促凋亡细胞因子,诱导毛囊 (HF) 上皮细胞凋亡并抑制增殖。它们还可能通过反馈回路影响压力介质及其受体的局部产生。总之,这将导致 HF 在毛发周期的休止期停滞,或通过诱导毛发生长期提前终止毛发生长阶段。 作为这些发现的临床相关性,通过观察发现所有这些效应(局部炎症反应、细胞凋亡、增殖减少、毛发生长停滞)都可以通过神经激肽-1受体(NK-1)拮抗剂(NK-1)的全身治疗来消除。因此,能够调节 P 物质和 CGRP 释放的神经化妆品成分可用于改善毛发的生长。例如,乙酰四肽-15( Acetyl Tetrapeptide-15)能减少促炎性神经介质(包括 CGRP)的释放,可以作为一种神经化妆品成分。[18]事实上,更多的研究已经开始关注如何通过“脑-毛囊轴” 神经免疫信号通路调节毛囊组织,在不同时空环境背景下的生理行为或免疫反应。Hsu, Y. C.等的研究发现压力导致的脱发存在逆转的可能性 [19](如图6所示)。
有关肾上腺分泌的应激激素皮质酮调节小鼠毛囊干细胞(HFSC)的静止和毛发生长的研究表明: 如果没有全身皮质酮,HFSC 在整个生命周期中会进入更多轮的再生周期。 相反,在慢性压力下,皮质酮水平升高会延长 HFSC 的静止状态,并使毛囊保持较长的静止期。从机制上解释了压力会导致脱发(图4)、皮质酮作用于真皮乳头 (DP)以及抑制分泌因子生长停滞特异性 6 (Gas6) 的表达。 恢复 Gas6 表达可以克服应激诱导的 HFSC 激活和毛发生长抑制。 该研究工作通过其对生态位的影响将皮质酮确定为 HFSC 活性的系统抑制剂,并证明了消除这种抑制会促使 HFSC 进入频繁的再生周期,且长期没有可观察到的缺陷。也就是说压力导致的脱发存在逆转的可能性,但这还有待通过人体毛囊干细胞的研究进一步确认。尽管导致脱发的原因很多,如受到雄激素和遗传基因的影响产生的脱发、将毛囊干细胞锚定于基底膜的跨膜XVII型胶原蛋白的老化流失导致脱发(不可逆)等,但“脑-毛囊轴”的神经内分泌免疫网络调控无疑是头皮护理神经化妆品研发的重要靶标。

图 4. 压力导致的脱发存在逆转的可能性 [19]
作为内分泌激素的皮质醇,不能作为化妆品原料直接使用,但谷氮酸(L- Glutamic acid-简称GA)及其衍生物y-氨基丁酸( Gamma- aminobutyricacid-简称GABA)和谷氨酰胺(L- Glutamine-简称GAM)却是常见的化妆品原料,可同时作为神经递质参与脑信息传递,维持中枢神经系统的神经信号的畅通。
谷氨酸是一种兴奋性神经递质,它可通过增加神经元的放电刺激大脑,作用于大脑和外周组织;γ-氨基丁酸是一种抑制性神经递质,可通过降低神经元和神经细胞的活性起到镇静的作用;谷氨酰胺则可以很容易地通过血脑屏障,是大脑的主要能量来源以及谷氨酸和γ-氨基丁酸活性的介体。
最近的研究发现:外源性谷氨酸能促进毛发生长和角质形成细胞增殖。[20]谷氨酸的局部应用降低了与皮肤细胞凋亡相关的基因的表达,而谷氨酸增加了人类角质形成细胞培养物中的细胞活力和增殖。该神经递质介导的新型皮肤信号通路对毛发生长的影响和安全性还有待进一步研究,因为谷氨酸受体分布异常通常发生在牛皮癣、皮肤再生等皮肤过度增生的情况下。
有趣的是研究表明:超高分子量聚-γ-谷氨酸(UHMW γ-PGA)通过抑制5-α还原酶活性, 有效诱导休止期小鼠的毛发生长初期来促进毛发生长,可配合米诺地尔(minoxidil)用于治疗男性雄激素性脱发。[21,22]米诺地尔通过打开 ATP 敏感钾通道通道(ATP-sensitive potassium channels, KATP)增加头皮中的皮肤血流量。 KATP 家族由受细胞内 ATP 和 ADP 水平调节的钾通道组成,尽管这些通道在感觉神经元和毛囊中的直接表达仍存在争议,但米诺地尔可以刺激头发生长是公认的事实。[23]
嗅觉神经系统的应激可以直接反应到脑。事实上,人类很早就学会使用香水来调节心理压力。嗅觉受体可以由全身不同类型的细胞表达,并调节嗅觉以外的生理细胞功能。 特别是嗅觉受体 OR2AT4 已被证明可以刺激皮肤角质形成细胞增殖。 Paus, R. [24]等人发现了人类毛囊的上皮,特别是外根鞘,表达的嗅觉受体OR2AT4。合成檀香气味剂 (Sandalore®) 对 OR2AT4 的特异性刺激可通过减少细胞凋亡和增加生长期延长生长因子 IGF-1 的产生,来延长人类毛发离体生长。 相反,同时施用特异性 OR2AT4 拮抗剂 Phenirat® 和沉默 OR2AT4则会抑制毛发生长。 总之,人类毛囊可以参与嗅觉受体依赖性化学感觉,并通过嗅觉受体 OR2AT4 介导的信号传导来维持其生长,这表明嗅觉受体可以作为脱发治疗的靶点之一。
此外,环境温度变化同样可以影响毛发的生长。众所周知,交感神经元可以支配立毛肌。立毛肌是一束与每个毛囊中的 HFSC 连接的平滑肌细胞(图2 )。 寒冷的气温会引起交感神经系统的活动升高,并导致受神经支配的立毛肌收缩,将头发拉直,这种反应称为立毛或起鸡皮疙瘩。立毛只是一种快速的、一线的防寒防御措施。交感神经利用立毛肌作为高速公路,也支配 HFSC。在小鼠中,寒冷温度下交感神经活动升高导致 HFSC 过早激活,从而再生新的毛皮。这种机制允许动物在冬季长出更厚的毛皮以保温,满足季节性的需求。[25]温泉洗浴是人们一种减轻压力的方式,同时也是一种通过温度变化刺激激活交感神经活动的行为。除了温度变化之外,光不仅影响皮肤的光老化,还可调节内部昼夜节律并与局部神经内分泌系统沟通。通过强蓝光刺激激活交感神经活动也会导致毛发生长。Buscone 等人在毛发生长初期毛囊中检测到 OPN2 和 OPN3,并证明蓝光(453 nm)对应OPN3的吸收光谱,延长毛发生长期。[26] 其分子靶点和机制将可能为脱发患者利用光疗法打开新的大门。[27]
白发逆转的可能性
压力会抑制毛发生长,同样也会导致头发变白。压力导致的脱发存在逆转的可能性,而白发逆转的可能性却还存在着争议。白发能否逆转始终毛囊生物学研究的重点课题之一。有关头发变灰白的机理解释存在二个主要流派:
以Ralf Paus和Desmond J. Tobin为代表的研究小组关注黑素细胞的功能及活性变化。黑素细胞不仅可以合成黑色素,还作为感觉细胞具备光和气味感知能力,可分泌神经递质、神经肽和其它激素,作为毛囊复杂神经内分泌网络的一部分,介导表皮免疫反应,抵消环境压力。该小组认为白发发生是毛囊黑素细胞的耗竭或功能障碍引起的,导致黑素细胞耗竭或功能障碍的原因包括各种氧化应激,基因毒素等。[28,29,30]
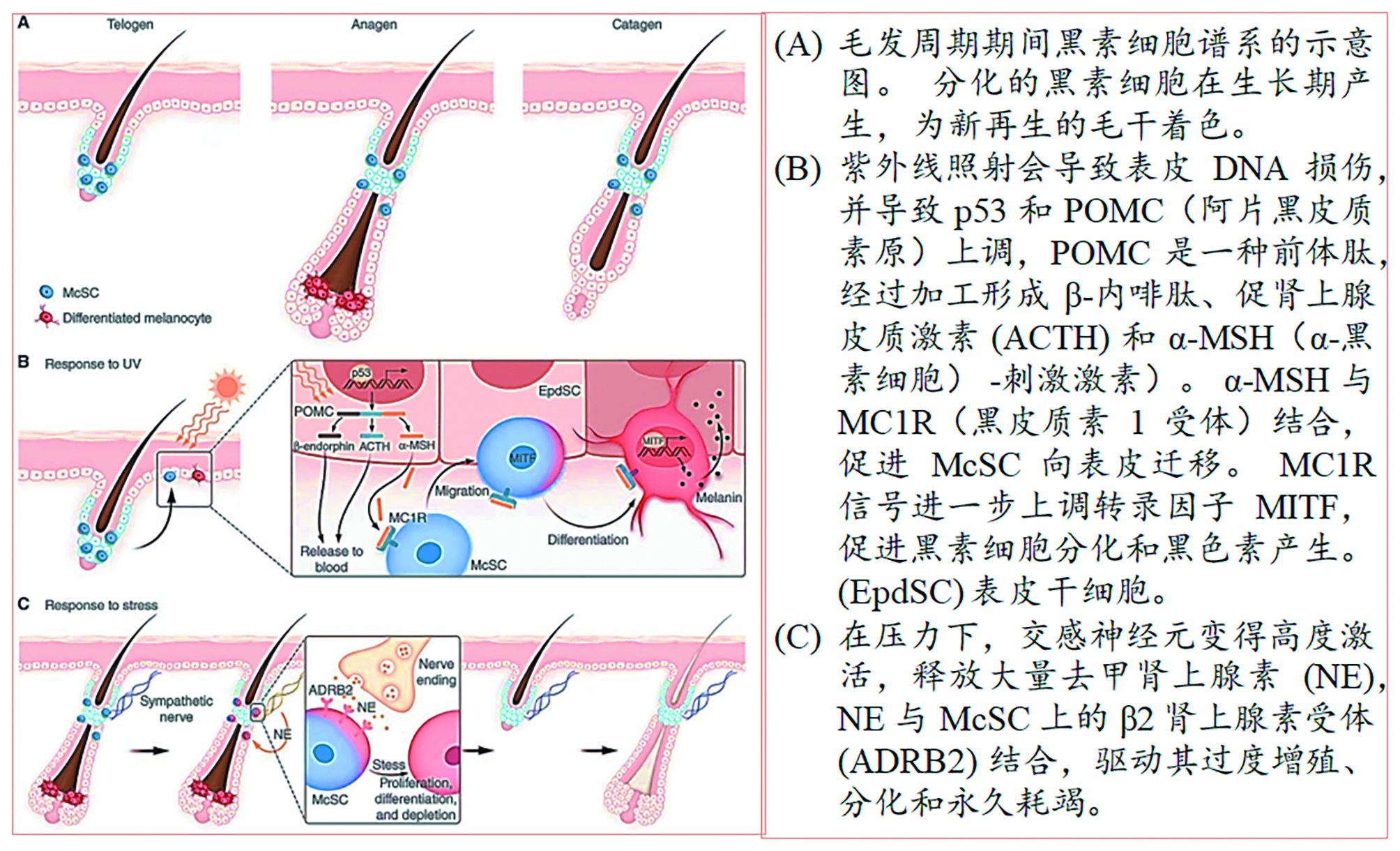
图 5. 黑素细胞干细胞 (MscSC) 对紫外线 (UV) 和压力的反应 [9]
以David E. Fisher为代表的研究小组关注毛囊干细胞群如何应对时空生态环境的变化,共同维护毛囊组织的稳定。认为头发变白是由于黑素细胞干细胞自我维持能力的缺陷造成的。[31,32] 如图5所示为黑素细胞干细胞 (melanocyte stem cell,McSC) 及其对紫外线 (UV) 和压力的不同反应路径。
毛囊的再生潜力和毛囊干细胞群有关。表皮干细胞,维持表皮层; 毛囊干细胞(HFSCs),为毛囊的循环生长提供动力;MsSC可再生产生色素的黑素细胞,从而使皮肤和头发着色。源自神经嵴的毛囊黑素细胞干细胞,和位于毛囊凸起部和毛胚中的毛囊干细胞(HFSCs)交织在一起,与 HFSC 一样,MeSC 在毛发周期的大部分时间都处于静止状态,仅在毛发生长初期短暂激活。[33]HFSC 和 MeSC 的同时激活可确保毛发生长初期的色素毛发再生,HFSC 产生毛囊和毛发,而MsSC 产生分化的黑色素细胞,使毛发着色。[34]
Nishimura,E.M. 研究小组[31]发现MsSC 在其毛囊生态位的生存竞合中比其它成体干细胞群更早失效,会导致头发无色素或头发变白,是一种与衰老相关的表象。
Hsu, Y. C. 研究小组[32]证明交感神经元可以驱动压力引起的头发变白。实验用小鼠的交感神经系统在急性应激下的过度激活,引发战斗或逃跑反应。毛囊附近的交感神经轴突末端分泌的过量去甲肾上腺素与 MeSC 上的 ADRB2 受体结合,驱使 McSC 进入快速增殖状态,随后迁移、分化,并从凸起处永久耗尽。一般认为McSC永久耗尽导致的白发是不可逆的。如果McSC没有被永久耗尽,压力引起的头发变白是否存在逆转的可能性。去甲肾上腺素会触发位于人类毛囊内的 McSC 的类似变化,这表明类似的机制也可能发生在人类身上。[35]
靶向去甲肾上腺素的神经美容成分已被设计用来恢复黑色素的产生。如MelanoGray™所含柑橘提取物是一种天然成分,可通过增强黑色素生成和黑素细胞增殖来减少白发比例,减少去甲肾上腺素引起的黑色素细胞应激。[36]同样,棕榈酰四肽-20(一种α-黑素细胞刺激激素激动剂的仿生肽)可激活 TRP-1 和黑色素的产生。[37]
除了与压力有关之外,头发变白还会随着年龄的增长而发生。自然衰老的特点是组织稳态和再生能力下降,这在一定程度上归因于成体干细胞的变化。有趣的是,接受部分交感神经切除术(去除交感神经支配)的患者随着年龄的增长,不再有交感神经支配的一侧出现更少的未色素毛发[38,39]。 因此,交感神经系统可能导致与年龄相关的 MeSC 逐渐丧失,而交感神经系统在急性应激下的过度激活可能会加速这一过程。老化皮肤还表现出许多再生缺陷,包括毛囊再生能力下降和伤口愈合延迟,其中一些缺陷在压力下也会出现[19,40,41]。 进一步研究压力反应和衰老过程之间的相似性和差异,将为了解交感神经如何导致这两个过程中的组织衰退提供新的见解,并确定阻止或逆转这些变化的潜在方法。
尽管 McSC 和 HFSC 存在共生关系,但每种干细胞群仍然至少保留了对其自身命运的部分控制。Mayymi Ito 研究小组[42]观察 了McSCs 在每个毛囊内的移动和老化。他们发现大多数 McSCs 在最原始的干细胞状态和成熟的下一阶段(过渡扩增状态)之间转换,以实现自我更新和成熟后代的生成,而这一细胞状态的转换还取决于它们所处的微环境。研究人员发现:随着头发老化、脱落,然后重新生长,越来越多的 McSCs 被卡在毛囊的隆突区,McSC 和 HFSC 之间的共生关系被破化,迁移到毛乳头附件的HFSC被单独激活,导致生成白发。这项研究颠覆了长期以来干细胞单向分化的教条。新发现的机制提出了黑素细胞干细胞固定定位,迁移及细胞状态的转换的问题。它提供了一种潜在的途径,通过干细胞再生及帮助停滞的细胞在发育中的毛囊区间再次移动,来预防或逆转人类头发的变白。
结论
心理神经内分泌免疫学的发展为心理美容学奠定了理论基础。心理美容学将人体视为一个整体,[43]注重大脑和皮肤之间的双向沟通。旨在探索这样一个概念:一方面,精神状态对皮肤的健康和外观有直接影响。恐惧、压力及害怕等负面情绪会通过神经系统在皮肤表面表现出寒毛直立、出冷汗、脸部血管扩张,严重时还会导致面部暗沉发黄、松弛下垂、泛红敏感、炎症及痤疮等问题;而愉悦的情绪则对皮肤状态有明显的改善作用。另一方面,通过积极地调节心理压力(stress)和免疫反应之间的平衡可以促进皮肤的健康。
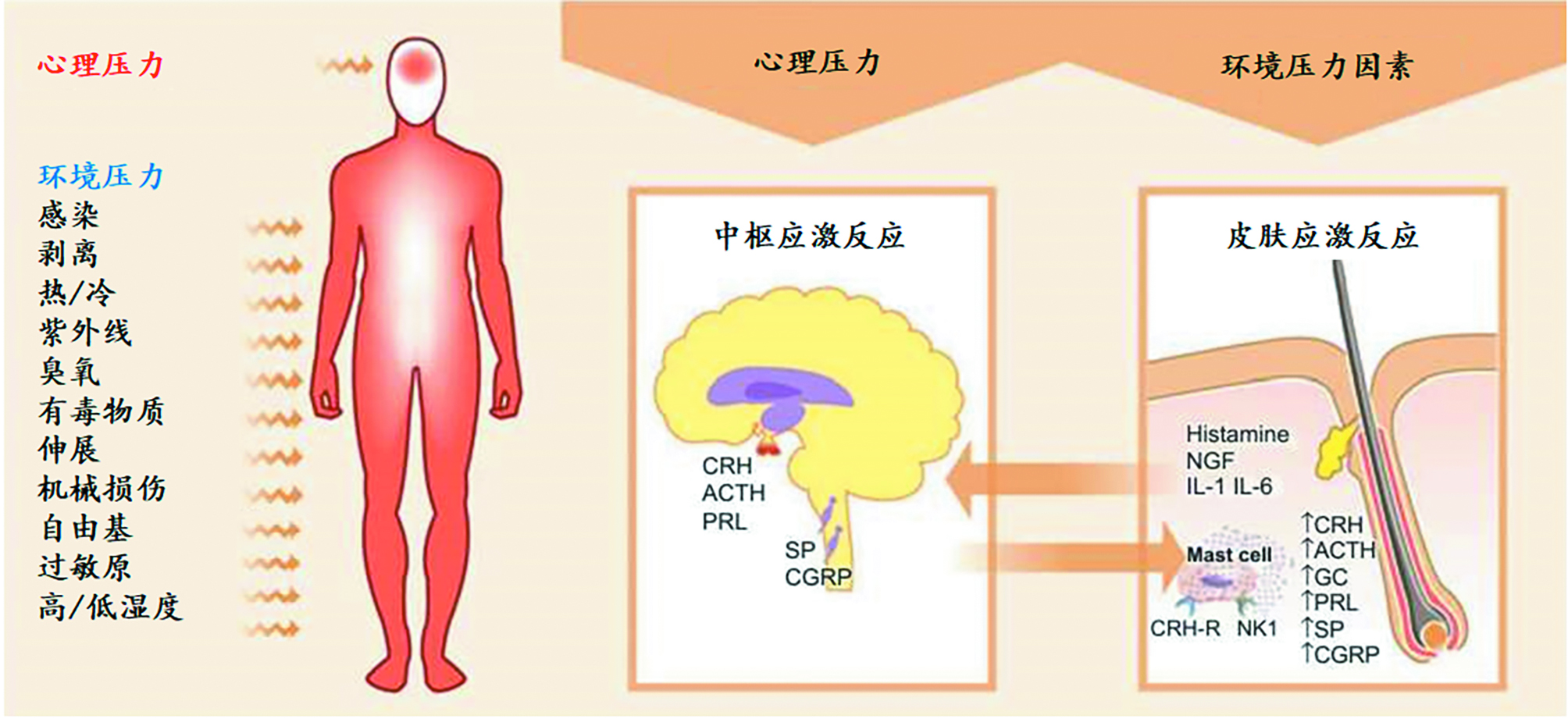
图 6. 压力和应激反应 [43]
心理美容行为不仅限于化妆品领域的应用,但化妆品却是一个不可或缺的良好选择。尽管化妆品不是药物,但其在促进人们身心健康方面却发挥着重要的作用,因为它能帮助改善人们的情绪,传递情感,提高社会认同和生活质量。因此,广义来讲所有化妆品都可以被认为是心理美容产品,当然也包括神经化妆品。相对而言,所谓的神经化妆品更侧重于缓解环境压力对皮肤健康的负面影响。通常是以主要应激介质如神经递质、激素和神经肽等为靶标,通过调节皮肤神经内分泌免疫平衡来维护皮肤稳态。
目前,化妆品心理作用的相关功效还需要通过建立相应的法规及评测方法来保障。我们相信,未来有数据支撑的“情绪护肤、护发”将不再只是一个概念。以大脑-毛囊轴神经内分泌免疫网络为靶标的头皮神经化妆品未来可期。
作者:甘智斌,杨建中
来源:美研创新株式会社
参考文献:
[1] Rizzi, V.; Gubitosa, J.; Fini, P.; Cosma, P. Neurocosmetics in Skincare—The Fascinating World of Skin–Brain Connection: A Review to Explore Ingredients, Commercial Products for Skin Aging, and Cosmetic Regulation. Cosmetics 2021, 8, 66. https://doi.org/10.3390/cosmetics8030066
[2] www.cosmeticsandtoiletries.com/magazine/article/22249970/antalgenics-sl-neurocosmetic-targets-for-scalp-and-hair-care
[3] Nikolaeva-Koleva, M., Butron, L., González-Rodríguez, S., Devesa, I., Valente, P., Serafini, M., Genazzani, A. A., Pirali, T., Ballester, G. F., Fernández-Carvajal, A., & Ferrer-Montiel, A. (2021). A capsaicinoid-based soft drug, AG1529, for attenuating TRPV1-mediated histaminergic
[4] Ader, R., & Cohen, N. (1975). Behaviorally conditioned immunosuppression. Psychosomatic medicine, 37(4), 333–340. https://doi.org/10.1097/00006842-197507000-00007
[5] Psychoneuroimmunology - Wikipedia
[6] 张洪亮 刘强 杨竞 王韵 祁海 段树民 徐岩英 神经免疫学关键科学问题与展望.中国科学基金2023 Vol. 37(2): 285-295
[7] Jin, R., Luo, L., & Zheng, J. (2022). The Trinity of Skin: Skin Homeostasis as a Neuro-Endocrine-Immune Organ. Life (Basel, Switzerland), 12(5), 725. https://doi.org/10.3390/life12050725
[8] Marek-Jozefowicz, L., Nedoszytko, B., Grochocka, M., Żmijewski, M. A., Czajkowski, R., Cubała, W. J., & Slominski, A. T. (2023). Molecular Mechanisms of Neurogenic Inflammation of the Skin. International journal of molecular sciences, 24(5), 5001. https://doi.org/10.3390/ijms24055001
[9] Hsu, Y. C., & Fuchs, E. (2022). Building and Maintaining the Skin. Cold Spring Harbor perspectives in biology, 14(7), a040840. https://doi.org/10.1101/cshperspect.a040840
[10] Joost, S., Annusver, K., Jacob, T., Sun, X., Dalessandri, T., Sivan, U., Sequeira, I., Sandberg, R., & Kasper, M. (2020). The Molecular Anatomy of Mouse Skin during Hair Growth and Rest. Cell stem cell, 26(3), 441–457.e7. https://doi.org/10.1016/j.stem.2020.01.012
[11] Hsu, Y. C., & Fuchs, E. (2022). Building and Maintaining the Skin. Cold Spring Harbor perspectives in biology, 14(7), a040840. https://doi.org/10.1101/cshperspect.a040840
[12] Godinho-Silva, C., Cardoso, F., & Veiga-Fernandes, H. (2019). Neuro-Immune Cell Units: A New Paradigm in Physiology. Annual review of immunology, 37, 19–46. https://doi.org/10.1146/annurev-immunol-042718-041812
[13] Misery L. (1996). Le système neuro-immuno-cutané (SNIC) [Neuro-immuno-cutaneous system (NICS)]. Pathologie-biologie, 44(10), 867–874.
[14] Misery L. (2002). Les nerfs à fleur de peau. International journal of cosmetic science, 24(2), 111–116. https://doi.org/10.1046/j.1467-2494.2002.00134.x
[15] Lombardi, S.A.; Ratti, A. Neurocosmesi, psicocosmesi e neuroscienze: Cosa sono? Kosmet. Numer art-3.1.pdf (bregaglio.eu)
[16] Peters, E. M., Arck, P. C., & Paus, R. (2006). Hair growth inhibition by psychoemotional stress: a mouse model for neural mechanisms in hair growth control. Experimental dermatology, 15(1), 1–13. https://doi.org/10.1111/j.0906-6705.2005.00372.x
[17] O'Sullivan, J. D. B., Peters, E. M. J., Amer, Y., Atuluru, P., Chéret, J., Rosenberg, A. M., Picard, M., & Paus, R. (2022). The impact of perceived stress on the hair follicle: Towards solving a psychoneuroendocrine and neuroimmunological puzzle. Frontiers in neuroendocrinology, 66, 101008. https://doi.org/10.1016/j.yfrne.2022.101008
[18] Resende, D. I. S. P., Ferreira, M. S., Sousa-Lobo, J. M., Sousa, E., & Almeida, I. F. (2021). Usage of Synthetic Peptides in Cosmetics for Sensitive Skin. Pharmaceuticals (Basel, Switzerland), 14(8), 702. https://doi.org/10.3390/ph14080702
[19] Choi, S., Zhang, B., Ma, S., Gonzalez-Celeiro, M., Stein, D., Jin, X., Kim, S. T., Kang, Y. L., Besnard, A., Rezza, A., Grisanti, L., Buenrostro, J. D., Rendl, M., Nahrendorf, M., Sahay, A., & Hsu, Y. C. (2021). Corticosterone inhibits GAS6 to govern hair follicle stem-cell quiescence. Nature, 592(7854), 428–432. https://doi.org/10.1038/s41586-021-03417-2
[20] Jara, C. P., de Andrade Berti, B., Mendes, N. F., Engel, D. F., Zanesco, A. M., Pereira de Souza, G. F., de Medeiros Bezerra, R., de Toledo Bagatin, J., Maria-Engler, S. S., Morari, J., Velander, W. H., Velloso, L. A., & Araújo, E. P. (2021). Glutamic acid promotes hair growth in mice. Scientific reports, 11(1), 15453. https://doi.org/10.1038/s41598-021-94816-y
[21] Choi, J. C., Uyama, H., Lee, C. H., & Sung, M. H. (2015). In vivo hair growth promotion effects of ultra-high molecular weight poly-γ-glutamic acid from Bacillus subtilis (Chungkookjang). Journal of microbiology and biotechnology, 25(3), 407–412. https://doi.org/10.4014/jmb.1411.11076
[22] Kim, H. S., Kwon, H. K., Lee, D. H., Le, T. N., Park, H. J., & Kim, M. I. (2019). Poly(γ-Glutamic Acid)/Chitosan Hydrogel Nanoparticles For Effective Preservation And Delivery Of Fermented Herbal Extract For Enlarging Hair Bulb And Enhancing Hair Growth. International journal of nanomedicine, 14, 8409–8419. https://doi.org/10.2147/IJN.S227514
[23] Messenger, A. G., & Rundegren, J. (2004). Minoxidil: mechanisms of action on hair growth. The British journal of dermatology, 150(2), 186–194. https://doi.org/10.1111/j.1365-2133.2004.05785.x
[24] Chéret, J., Bertolini, M., Ponce, L., Lehmann, J., Tsai, T., Alam, M., Hatt, H., & Paus, R. (2018). Olfactory receptor OR2AT4 regulates human hair growth. Nature communications, 9(1), 3624. https://doi.org/10.1038/s41467-018-05973-0
[25] Shwartz, Y., Gonzalez-Celeiro, M., Chen, C. L., Pasolli, H. A., Sheu, S. H., Fan, S. M., Shamsi, F., Assaad, S., Lin, E. T., Zhang, B., Tsai, P. C., He, M., Tseng, Y. H., Lin, S. J., & Hsu, Y. C. (2020). Cell Types Promoting Goosebumps Form a Niche to Regulate Hair Follicle Stem Cells. Cell, 182(3), 578–593.e19. https://doi.org/10.1016/j.cell.2020.06.031
[26] Buscone, S., Mardaryev, A. N., Raafs, B., Bikker, J. W., Sticht, C., Gretz, N., Farjo, N., Uzunbajakava, N. E., & Botchkareva, N. V. (2017). A new path in defining light parameters for hair growth: Discovery and modulation of photoreceptors in human hair follicle. Lasers in surgery and medicine, 49(7), 705–718. https://doi.org/10.1002/lsm.22673
[27] Suh, S., Choi, E. H., & Atanaskova Mesinkovska, N. (2020). The expression of opsins in the human skin and its implications for photobiomodulation: A Systematic Review. Photodermatology, photoimmunology & photomedicine, 36(5), 329–338. https://doi.org/10.1111/phpp.12578
[28] Tobin, D. J., & Paus, R. (2001). Graying: gerontobiology of the hair follicle pigmentary unit. Experimental gerontology, 36(1), 29–54. https://doi.org/10.1016/s0531-5565(00)00210-2
[29] O'Sullivan, J. D. B., Nicu, C., Picard, M., Chéret, J., Bedogni, B., Tobin, D. J., & Paus, R. (2021). The biology of human hair greying. Biological reviews of the Cambridge Philosophical Society, 96(1), 107–128. https://doi.org/10.1111/brv.12648
[30] Chen, Y. Y., Liu, L. P., Zhou, H., Zheng, Y. W., & Li, Y. M. (2022). Recognition of Melanocytes in Immuno-Neuroendocrinology and Circadian Rhythms: Beyond the Conventional Melanin Synthesis. Cells, 11(13), 2082. https://doi.org/10.3390/cells11132082
[31] Nishimura, E. K., Granter, S. R., & Fisher, D. E. (2005). Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science (New York, N.Y.), 307(5710), 720–724. https://doi.org/10.1126/science.1099593
[32] Zhang, B., Ma, S., Rachmin, I., He, M., Baral, P., Choi, S., Gonçalves, W. A., Shwartz, Y., Fast, E. M., Su, Y., Zon, L. I., Regev, A., Buenrostro, J. D., Cunha, T. M., Chiu, I. M., Fisher, D. E., & Hsu, Y. C. (2020). Hyperactivation of sympathetic nerves drives depletion of melanocyte stem cells. Nature, 577(7792), 676–681. https://doi.org/10.1038/s41586-020-1935-3
[33] Chang, C. Y., Pasolli, H. A., Giannopoulou, E. G., Guasch, G., Gronostajski, R. M., Elemento, O., & Fuchs, E. (2013). NFIB is a governor of epithelial-melanocyte stem cell behaviour in a shared niche. Nature, 495(7439), 98–102. https://doi.org/10.1038/nature11847
[34] Lu, Z., Xie, Y., Huang, H., Jiang, K., Zhou, B., Wang, F., & Chen, T. (2020). Hair follicle stem cells regulate retinoid metabolism to maintain the self-renewal niche for melanocyte stem cells. eLife, 9, e52712. https://doi.org/10.7554/eLife.52712
[35] Rachmin, I., Lee, J. H., Zhang, B., Sefton, J., Jung, I., Lee, Y. I., Hsu, Y. C., & Fisher, D. E. (2021). Stress-associated ectopic differentiation of melanocyte stem cells and ORS amelanotic melanocytes in an ex vivo human hair follicle model. Experimental dermatology, 30(4), 578–587. https://doi.org/10.1111/exd.14309
[36] Faria, A. R., Jung, J. E., Silva de Catro, C. C., & de Noronha, L. (2018). Reduced immunohistochemical expression of CCN3 in vitiligo. Indian journal of dermatology, venereology and leprology, 84(5), 558–562. https://doi.org/10.4103/ijdvl.IJDVL_954_16
[37] Almeida Scalvino, S., Chapelle, A., Hajem, N., Lati, E., Gasser, P., Choulot, J. C., Michel, L., Hocquaux, M., Loing, E., Attia, J., & Wdzieczak-Bakala, J. (2018). Efficacy of an agonist of α-MSH, the palmitoyl tetrapeptide-20, in hair pigmentation. International journal of cosmetic science, 40(5), 516–524. https://doi.org/10.1111/ics.12494
[38] Lerner A. B. (1966). Gray hair and sympathectomy. Report of a case. Archives of dermatology, 93(2), 235–236.
[39] Ortonne, J. P., Thivolet, J., & Guillet, R. (1982). Graying of hair with age and sympathectomy. Archives of dermatology, 118(11), 876–877. https://doi.org/10.1001/archderm.118.11.876a
[40] Keyes, B. E., Liu, S., Asare, A., Naik, S., Levorse, J., Polak, L., Lu, C. P., Nikolova, M., Pasolli, H. A., & Fuchs, E. (2016). Impaired Epidermal to Dendritic T Cell Signaling Slows Wound Repair in Aged Skin. Cell, 167(5), 1323–1338.e14. https://doi.org/10.1016/j.cell.2016.10.052
[41] Keyes, B. E., Segal, J. P., Heller, E., Lien, W. H., Chang, C. Y., Guo, X., Oristian, D. S., Zheng, D., & Fuchs, E. (2013). Nfatc1 orchestrates aging in hair follicle stem cells. Proceedings of the National Academy of Sciences of the United States of America, 110(51), E4950–E4959. https://doi.org/10.1073/pnas.1320301110
[42] Sun, Q., Lee, W., Hu, H., Ogawa, T., De Leon, S., Katehis, I., Lim, C. H., Takeo, M., Cammer, M., Taketo, M. M., Gay, D. L., Millar, S. E., & Ito, M. (2023). Dedifferentiation maintains melanocyte stem cells in a dynamic niche. Nature, 616(7958), 774–782. https://doi.org/10.1038/s41586-023-05960-6
[43] Arck, P. C., Slominski, A., Theoharides, T. C., Peters, E. M., & Paus, R. (2006). Neuroimmunology of stress: skin takes center stage. The Journal of investigative dermatology, 126(8), 1697–1704. https://doi.org/10.1038/sj.jid.5700104
来源:荣格-《 国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。

