荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
诺华制药旗下的山德士(Sandoz)的Tyruko(natalizumab-sztn)成为美国食品药品监督管理局(FDA)首个批准的用于治疗多发性硬化症(MS)复发型患者的生物类似药,其原研药为百健(Biogen)的Tysabri(natalizumab)注射液。
多发性硬化症是一种影响中枢神经系统的自身免疫性疾病,导致神经髓鞘损伤,引起各种神经功能障碍。目前,没有根治的方法,只能通过药物控制病情的进展和复发。
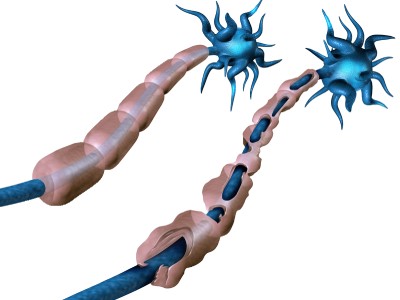
Tyruko是美国FDA首个批准的用于治疗多发性硬化症的生物类似药,它与原研药Tysabri具有相同的活性成分——natalizumab,这是一种针对α4整合素的单克隆抗体,可以阻断白细胞进入中枢神经系统,从而减轻神经髓鞘的损害。
Tyruko由山德士开发并获得批准,适用于以下类型的MS复发型患者:
- 临床孤立综合征——MS症状的单次、首次发作
- 复发缓解型——这种类型的MS表现为新的神经症状发作后有稳定期
- 活动性继发性进行性——在复发缓解型之后,患者逐渐出现残疾加重,并持续复发
此外,Tyruko还适用于中度至重度活动性克罗恩病(CD)患者,这是一种肠道炎症性疾病。Tyruko只能用于那些对常规CD治疗和肿瘤坏死因子(TNF-α)抑制剂无效或不耐受的患者。
根据山德士的说法,Tysabri作为参比药物,是一种高效的抗α4整合素单克隆抗体修饰性治疗。
山德士北美区总裁Keren Haruvi表示,“在美国有近一百万人患有多发性硬化症,其中数十万人经历过复发”。Haruvi还说,Tyruko有可能扩大纳塔利珠单抗治疗的覆盖范围,并“通过市场竞争促进创新”。
由于Tyruko存在导致一种名为进行性多灶性白质脑病(PML)的病毒感染风险,因此该药只能通过风险评估和缓解策略(REMS)获得。
2019年,山德士与Polpharma Biologics签订了Tyruko的全球商业化协议。根据协议的条款,Polpharma Biologics将负责Tyruko的开发、生产和供应。山德士获得了在所有市场上商业化和分销Tyruko的全球独家许可。
近期,山德士宣布已经申请了其用于治疗湿性黄斑变性的aflibercept生物类似药的批准。

此外,山德士最近宣布,其目前计划在2023年10月4日左右实施其从诺华分拆的计划。为了为这一转变做好准备,山德士司在2023年6月初宣布,将把总部迁至瑞士的巴塞尔。
综合编译自相关公司新闻稿及报道等资讯