荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
根据MarketsandMarkets的报告,全球环境监测市场预计将从 2021 年的 14.3 亿美元增长到 2026 年的 19.5 亿美元,复合年增长率为 6.4%。制药行业是环境监测市场的主要细分领域之一,其增长主要受几个因素的驱动——GMP 法规的严格执行、无菌生产和生物制品生产的需求增加、疫苗和治疗药物的开发和生产、环境监测技术的创新和改进。

制药行业在质量管理方面面临着诸多挑战,其中之一就是环境监测。环境监测是保证无菌生产质量的关键环节,但也是最容易出现人为错误和偏差的环节。制药企业应采取措施来提高环境监测的质量,例如加强员工的培训和考核、采用自动化和数字化的环境监测系统、建立有效的数据分析和趋势评估机制、实施持续改进和风险管理计划等。
欧盟 GMP 附件 1 2022 年最新修订版的发布使得有必要对当前的环境监测(EM)实践进行审查,以确保已安装的监测系统包含并符合原有的监测要求和新制定的附件 1 规定。这篇文章带大家回顾自 2022 年 8 月发布附件 1 以来适用于系统设计的更全面的 EM 要求。
洁净室的分类
制药洁净室是根据空气中的颗粒浓度进行分类的,空气中的颗粒浓度必须满足正在进行的生产过程的洁净度标准。洁净室等级的确定是一个基于实际统计有效测量的过程,是洁净室过滤和运行状态的函数。从本质上讲,这是对洁净室进行校准,以确保其符合预定的等级。它主要不是应用风险的函数。
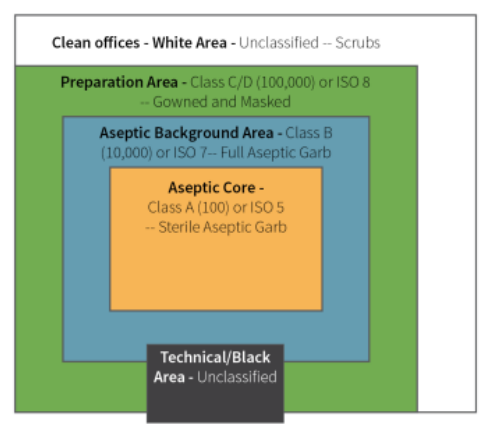
图 :洁净室各区域的典型ISO评级示意图
洁净室中的粒子计数分为三个测量阶段:
● 建成:已建成的房间,所有服务均已连接并正常运行,但设施内没有生产设备或人员。
● 静止:所有的服务都已连接,所有的设备都已安装并按照商定的方式运行,但没有人员在场。
● 运行: 所有设备均已安装,并按商定的方式运行,有指定数量的人员在场,并按商定的程序工作。
空气颗粒计数测试是在洁净室内规定的网格位置进行颗粒计数。测试点应在整个房间内和工作高度等距分布,以显示工作区域的空气洁净度质量。制药洁净室通常达到 5 级(大部分无菌区域)、7 级(周边区域)或 8 级(支持区域)。
制药洁净室的使用
一旦洁净室通过了符合洁净室分级的测试,所获得的分级就决定了哪些生产活动可以在该洁净室或洁净空气设备中进行。美国食品及药物管理局(FDA)定义了两个领域:
1.关键区域(Critical Areas):包含一旦暴露就容易受到污染的产品。这些区域在附件 1 中被指定为 A 级(ISO5)。为了保证产品的质量,必须对进行无菌操作的环境进行控制,并保持适当的质量。
2.辅助清洁区(Supporting Clean Areas):用于关键核心之外的所有其他活动,在附件 1 中被指定为 B/C/D 级,通常成品污染风险较低。
洁净室或洁净空气设备一旦通过认证活动证明符合洁净度要求,还必须证明在整个生产期间都能保持此类控制。必须对环境进行严格监控,以确保全面、持续地了解当前状况,包括检测周期性事件,这些事件如果被忽视可能会造成灾难性后果。
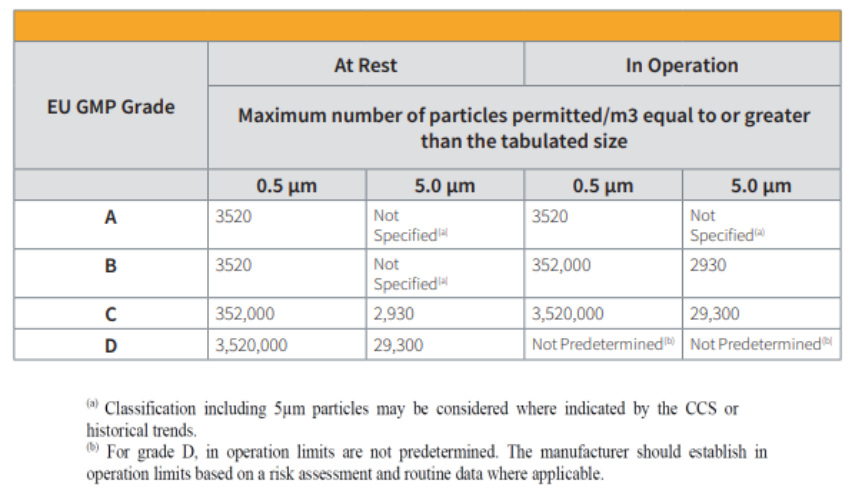
表 :欧盟GMP附件1室分类表(附件 1 2022)
因此,生产设施应制定全面的环境监测程序,其中包括监测空气中的无活力和有活力微粒、表面的有活力污染以及无菌区内的人员。这些程序应涉及监测频率和地点、警告和报警限制,以及在任何区域出现与预期结果不符的情况时应采取的纠正措施。
污染控制策略
污染控制策略(Contamination Control Strategy,CCS)将包括环境监测计划,并应在整个设施内实施。作为风险评估的一部分,污染控制战略应确定关键控制点,并且必须权衡用于管理污染相关风险的控制和监测措施的有效性。应经常对 CCS 进行审查,尤其是在实施的早期阶段,并应不断更新,以推动监测和控制方法的持续改进;最终提高工艺的整体质量。
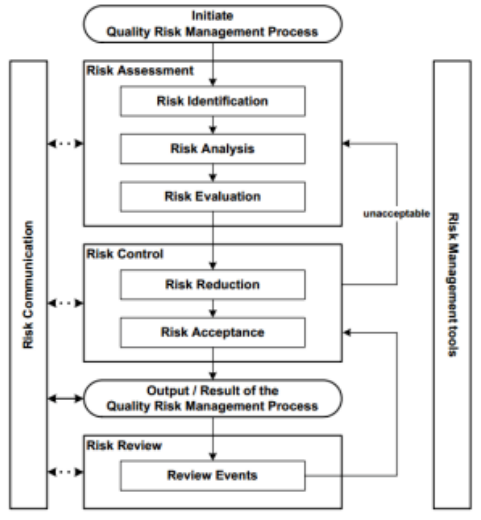
图 :风险识别与分析的步骤
环境监测要求
应使用符合风险评估需要的适当技术进行监测。对于较低等级区域的许多监测要求,可以部署和使用便携式仪器。
不过,A 级区域应使用适当的采样流速(至少 28.3 LPM / 1 CFM)进行连续监测(监测 ≥ 0.5 和 ≥ 5 µm 的颗粒),以便捕捉到所有干预、瞬态事件和系统恶化情况。系统应频繁地将每个样本结果与警报级别和行动限制相关联,以便及时发现和应对任何潜在的偏差。
如果超过警戒水平,则应触发警报,程序应规定针对警报应采取的行动。使用连接到中央监控软件的使用点专用传感器可满足 A 级区域内持续监控的要求,该软件应能够发送警报输出以便及时干预。取样点位置应根据记录在案的环境监测风险评估 (Environmental Monitoring Risk Assessment,EMRA)确定,并应包括以下信息:取样位置、监测频率、使用的监测方法和培养条件。
典型的自动连续监测系统
用于构建集成解决方案的仪器通常包括:
粒子计数(Particle Counting) - 由于需要连续数据,因此需要在每个位置安装专用传感器,以便在生产的设置和生产阶段进行连续采样。
微生物采样(Microbial Sampling) - 如果风险已确定需要进行总颗粒计数,则需要进行相关的微生物采样。
报警信标(Alarm Beacons) - 这些附加装置可进行本地报警(可视和可听),并在系统超出容许范围时向受控空间内的操作人员发出警报。
中央软件系统(Central Software System) - 系统采用工业自动化架构设计,由中央处理系统组成,该系统收集现场传感器的数据并控制远程设备,同时与监控和数据采集(Supervisory Control and Data Acquisition,SCADA)软件包进行通信。为与系统有效互动,应具备以下功能:数据和状态信息显示、用户和区域隔离、报告生成器和警报。
结语
对制药无菌生产环境的监控已得到广泛认可,附件 1(2022 年)修订版中提出的改动并未改变监控要求的许多方面。增加了正式风险评估,并将数据纳入综合控制系统,从而更全面地反映了根据过去法规安装的连续系统。在风险和数据审查的基础上,更加强调建立正确的采样位置和技术,以支持产品的释放。然而,与传统的对连续性系统的期望相比,强调提高了对文件的要求。
来源:荣格-《国际医药商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。