荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
在精准医疗的背景下,药物输送载体的开发需求巨大。随着合成生物学的发展,利用基因工程细菌(genetically engineered bacteria,GEB)作为给药载体受到越来越多的关注。这篇文章中,我们将回顾生物工程细菌作为药物载体的研究进展,重点介绍改造这些细菌的合成生物学策略,包括工程细菌的靶向实现方法、基因回路的设计方案和治疗化合物的释放途径等话题。
一个多世纪前,Paul Ehrlich提出了一种能像“神奇子弹”一样发挥作用的药物构想,这种药物能直达预定的细胞结构靶点,选择性地消除病变细胞,同时对周围的正常细胞无害。此后,靶向给药领域取得了长足的进步。给药系统是开发新药和改造旧药的关键组成部分。
以往的药物的局限性和挑战包括生物利用度有限、非特异性靶向、吸收有限和安全性。然而,开发一种新药费时费力,而且往往不成功。为此,人们开发了许多策略,包括个体化药物治疗、纳米颗粒给药系统、药物共轭给药系统、治疗药物监测和刺激敏感靶向治疗。
药物靶向治疗的基础是将高浓度药物输送到靶点,如特定器官、单个细胞或血管,同时尽量减少非靶点区域的药物浓度。药物的特定靶向性有助于优化治疗效果,同时减少因多靶点相互作用、高剂量和非靶点浓度而产生的副作用。
载体是一种专门设计的系统,对于将封装药物有效送达靶点至关重要。药物靶向复合物应无毒、无免疫原性、生化惰性、可生物降解、生物相容性好,并在体内和体外具有物理化学稳定性。载体应具有可预测、可控制的药物释放模式,制备过程具有可重复性和成本效益,易于体内排出,运输过程中药物泄漏量最小。
过去几十年来,最常见的策略是利用纳米技术来改造给药系统。纳米颗粒的优势很多,例如通过提高细胞摄取效率来增强疗效;基于其尺寸和流动性,对细胞和细胞内靶点具有更全面的靶向性,以及能提高靶点特异性和灵活性。尽管纳米技术具有多种优势,但其局限性也包括聚集和堵塞毛细血管。给药系统的不稳定性也可能导致药物在到达病变部位之前过早释放或泄漏。
合成生物学采用人工设计的生物系统作为靶向给药的替代方法。早在 20 世纪 90 年代对细菌进行完整的基因组测序之后,合成生物学领域就在千禧年前后兴起,并迅速发展。早期利用治疗策略的例子之一是利用合成回路进行细菌入侵肿瘤细胞。近年来,合成细菌被用于增强癌症治疗的放射治疗和免疫治疗。微生物可与合成生物学相结合,实现有效的药物靶向策略。
随着近代科学的发展,人们已开发出更复杂的策略来设计具有特定靶向性的给药载体。合成生物学方法包括将细菌作为一个独立的微型机器,用于执行医疗领域的程序任务。这些改造使细菌可以作为载体,将药物分子或蛋白质以及核酸转染到宿主细胞中。合成细菌的特性和易获取性为预防、诊断和治疗各种疾病提供了潜在的应用前景。
近年来的进展
设计精良的工程菌药物递送应用包括三个基本组成部分:病变组织靶向和调控输入信号、细胞内基因回路部分、活性化合物递送部分。一般来说,工程细菌可以靶向病变组织或器官,感知病变环境中的特定生物标志物或诱导特定条件。此外,精心设计的细胞内代谢途径可以激活或抑制相关基因的表达,合成具有生物活性的治疗分子,并在患病组织或器官中精确释放药物载荷。这些成分相互依存、相互制约,并具有多种功能。
工程微生物的调控输入信号和靶向性
大量研究表明,几种合成生物成分可有效改变细菌信号通路。细菌通过经典的双组分系统、群体感应(QS)系统、转录调节因子和胞质外功能 sigma 因子传递信息。
典型的双组分调控系统由细胞膜上的组氨酸激酶和下游的效应蛋白组成。从理论上讲,组氨酸激酶有可能被人工改造,并通过蛋白质的定向进化获得感知特定外部环境的能力。此外,还可以对下游调节因子进行改造,重新规划导致不同遗传事件的信号通路。在 QS 系统中,细菌会产生一种名为“自诱导剂”(autoinducer,AI)的有机分子来感知其种群密度,研究发现这些化合物的浓度会调节相关基因的表达。
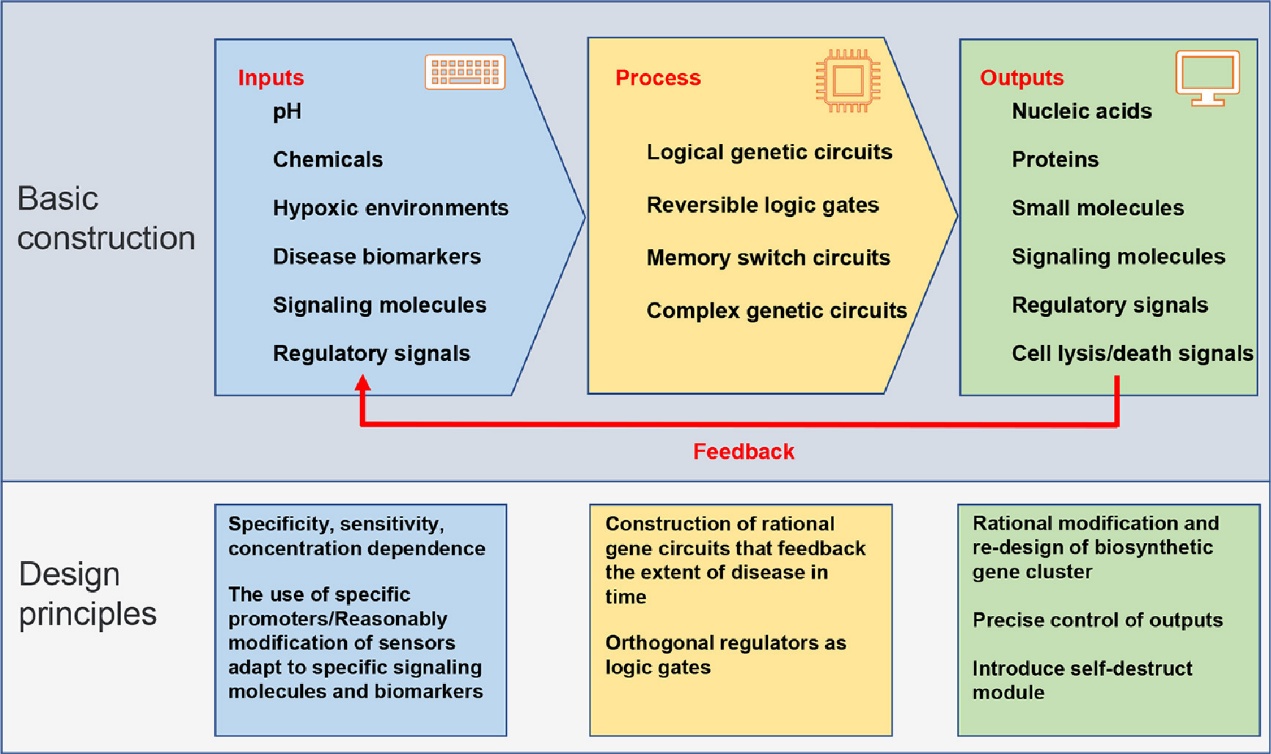
图 1.开发治疗工程菌的基本构造和设计原理
此外,自身诱导剂生物合成基因簇的靶基因表达水平的反馈作用也会调节自身诱导剂的浓度。已发现的自体诱导剂分子种类很多,最著名的例子是革兰氏阴性细菌经常使用的酰基高丝氨酸内酯(acyl-homoserine lactones,AHL)。自身诱导肽(autoinducing peptides,AIP)是革兰氏阳性细菌产生的主要自身诱导剂。其他 AIP包括假单胞菌喹诺酮信号(Pseudomonas quinolone signals,PQS)、吲哚和可扩散信号因子(diffusible signal factors。DSF)。这些小分子化合物可通过化学方法与其他生物标记物连接,引导工程细菌进入特定组织。
宿主细胞或器官可产生各种生物活性分子,如信号分子、细胞因子和酶。同时,病理变化与环境变化有关,如温度、pH 值和氧气浓度。因此,所设计的工程细菌对目标器官或组织的反应应具有高度特异性、敏感性和浓度依赖性,并能检测或感知与病变相关的特定生物标志物。
例如,高 NO 环境是炎症组织的特征标记,通常是工程细菌的目标。NO 传感系统 NorR 就是针对炎症组织中的工程细菌而设计的。四硫酸盐是一种硫代硫酸盐传感器,是炎症的生物标志物,改良的四硫酸盐传感器被用于诊断和治疗。例如,大肠杆菌被用于检测肠道炎症,含有生物合成基因簇的工程大肠杆菌由四硫酸盐诱导的启动子控制,产生微素 H47,用于治疗沙门氏菌感染。
信号输入或靶向在作为药物输送载体的工程活菌中较为常见,其中三种细菌底盘应用最为广泛。合成生物学中最常用的工程微生物之一源自人类的天然共生菌,如乳酸菌(lactic acid bacteria,LAB),这是一种能将碳水化合物发酵成乳酸的细菌的总称。LAB 菌株能在胃肠道(gastrointestinal tract,GIT)的恶劣条件下生存,并在特定的肠道组织中定植。由于重组 LAB 对恶劣条件具有很强的抵抗力,因此是粘膜递送抗原蛋白、药物分子和外来 DNA 的绝佳候选菌株。因此,它们可用于疫苗开发、药物输送、基因治疗和其他热门领域。
例如,经改造的乳酸乳球菌只有在检测到粪肠球菌产生的性信息素 cCF10 时,才会分泌抗肠道球菌肽,从而攻击导致感染的肠道粪肠球菌。当 cCF10 出现时,启动子会触发三个细菌素基因的产生,合成对粪肠球菌具有抗菌活性的肠球菌素 A、平霉素 JM79 和肠球菌素 P 黏膜给药是将 LAB 引入人体的最常见方法。酵母菌已进化出通过粘液层到达上皮细胞的特殊机制。通过粘膜给药系统利用 LAB 的一个例子就是防止 HIV 的进入。健康女性阴道粘膜中的许多共生细菌都含有能产生 H2O2 的乳酸杆菌,它们在预防泌尿生殖系统感染方面发挥着保护作用。从蓝藻 Nostoc ellipsosporum 中分离出来的 Cyanovirin-N(CV-N)是一种强效的 CCR5 和 CXCR4 型艾滋病毒抑制剂,可阻断导致膜融合和病毒进入的多个步骤。从阴道中分离出来的乳酸球菌(Lactococcus jensenii)被设计成能分泌 CV-N,从而有效抑制 CCR5 和 CXCR4 病毒。乳酸杆菌衍生的 CV-N 在体外浓度为 0.3 nM 时可抑制 CCR5-tropic HIVBaL 的感染性,在小鼠发情期阴道内给药时可产生全长 CV-N。分泌天然产物的生物工程细菌可以廉价、持久地阻止艾滋病毒在雌性动物中的异性传播。
与 LAB 不同,沙门氏菌是一种食源性致病菌,会引起食物中毒。沙门氏菌必须克服人类为抑制和杀死食源性病原体而适应的条件,如低 pH 值、高渗处理、低温和应激。因此,沙门氏菌进化出一种网络,以应对不断变化的环境挑战,保护自身免受应激条件的影响。因此,转基因沙门氏菌通过分泌含有抗癌药物的囊泡,可用作抗癌疗法。
由于实体瘤膜难以穿透,因此无法有效靶向关键的癌症通路。在这方面,生物工程沙门氏菌是通过靶向癌细胞坏死/缺氧区域递送治疗药物的理想候选菌。沙门氏菌能够选择性地在肿瘤中繁殖,并抑制肿瘤的生长。同时,沙门氏菌已被证明能定植和破坏肿瘤,并已成为肿瘤微环境的生物基因载体。
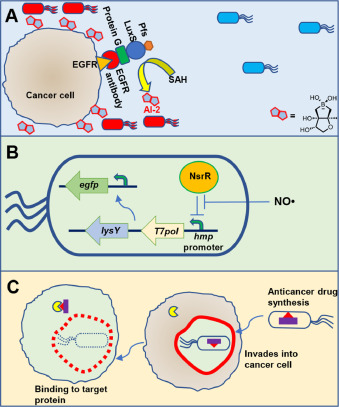
图 2. 靶向和信号输入实施示例。A:融合蛋白合成细菌 AI-2 靶向肿瘤细胞表面的表皮生长因子受体。AI-2 分子从细胞表面产生,由工程细菌根据 AI-2 水平识别,从而控制抗肿瘤药物的生物合成(蓝色:未诱导;红色:诱导)。B:工程细菌对一氧化氮(NO)做出反应并产生均匀的荧光反应。该系统使用 NO 响应启动子将原始信号放大到负责 GFP 表达的第二个载体中,并使用共同表达的 T7 溶菌酶(lysY)抑制 T7Po 以调节 T7lac 启动子的活性。C:调控蛋白复合物 FlhDC 可促进沙门氏菌侵入肿瘤细胞并释放纳米抗体等治疗载荷。
最近的研究开发出了一种高度改良的沙门氏菌菌株,它利用三个基因回路精确控制药物生产、细胞侵袭和蛋白质释放。利用主调节因子 flhDC 控制侵袭,可将输送效率提高 500 倍以上。一项研究发现,约 70% 的沙门氏菌可以进入肿瘤细胞,使治疗蛋白质直接在癌细胞内自主积累。清除肿瘤细胞后,细菌会自动消除,不会影响正常细胞。
由于大肠杆菌易于维护、产量高、系统完善,它是基因表达领域最主要的原核生物系统之一,并被广泛用于药物靶向和递送。大肠杆菌一直受到学术界和工业实验室的青睐,因为它能在廉价的培养基上增殖到很高的细胞密度,而且它的遗传学比其他任何微生物都更容易理解。可以对大肠杆菌进行基因工程改造,使其与接收特定信号(如人工智能)的传感器相匹配,也可以将其转化为药物载体,使其具有可控裂解靶细胞的特性。
例如,CD47 是近年来发现的有效抗肿瘤靶点之一。阻断CD47“别吃我”信号通路,可以增强巨噬细胞对肿瘤细胞的靶向性,并通过STING信号通路消除肿瘤。2022 年 1 月,吉利德的 Magrolimab 在一项临床试验中出现意外严重不良反应(SUSAR)后,FDA 部分暂停了该药的使用。CD47 靶向药物的安全性再次受到质疑。然而,最新的研究表明,工程大肠杆菌作为药物输送载体可以大大减轻药物的毒副作用,含有同步裂解电路的大肠杆菌菌株会产生一种法定量感应分子 AHL,作为控制大肠杆菌生长和裂解的信号,然后在肿瘤细胞中释放编码的 CD47 纳米抗体拮抗剂。
工程微生物的展望
虽然生物工程细菌引起了研究人员的兴趣,但在临床上使用这种方法却引起了争议。使用转基因微生物对人体安全的一个重要考虑因素。对转基因卵形芽孢杆菌(Bacteroides ovatus)的研究表明,转基因卵形芽孢杆菌可在胸腺嘧啶饥饿条件下存活,并在哺乳动物胃肠道内转移水平基因,从而产生携带野生型细菌的转基因细菌。这些结果引起了人们对转基因细菌进入人体系统后的不确定性以及它们如何与体内其他细菌相互作用的担忧。在普及和推广这种方法之前,需要更好地研究这些不确定性。为避免水平基因转移,直接在工程菌中使用游离质粒是不可取的。这需要将目标基因整合到基因组中,并在改造细菌基因组时去除整合酶。
人体内存在的一些菌株在转基因后很容易定植,被人体摄入后也很少有副作用的报道。不过,未来在人体中使用工程微生物之前,必须考虑到这一点。人体是否会通过与其他动物(如宠物)的种间微生物交换将基因工程微生物释放到自然环境中?为了尽量减少类似的担忧,需要设计具有适当基因模块的细菌,使其只能在人体甚至人体的特定组织或器官中存活,离开这些特定环境就无法存活。
有些研究表明,工程细菌可通过生物转化提供抗体等大分子蛋白质和小分子物质。此外,利用细菌产生的人工智能分子构建反馈基因回路也被用于构建治疗性工程细菌。不过,在许多情况下,这种系统更倾向于输送小型治疗药物。
令人感兴趣的是,临床上使用的大部分药物都来自生物合成基因簇合成的天然产物。利用工程细菌作为“载体”,将编码小分子化合物的生物合成基因簇精确地传递到靶蛋白,并开启基因簇,这听起来似乎是一个奇妙的故事。虽然研究人员在天然产物的生物合成方面取得了重大进展,但将天然产物或类似天然产物的生物合成基因簇直接输送到靶位点的情况还没有相关的结果。与大分子蛋白质不同,这些抗生素生物合成基因簇往往过于庞大,普通的异源表达技术无法预测最终的问题。
此外,这些庞大的生物合成基因簇,如聚酮肽合成酶(polyketide synthase,PKS)和非核糖体肽合成酶(non-ribosomal peptide synthase,NRPS),往往伴随着许多后修饰基因和调控基因。假设有可能完全重组和简化这些生物合成基因簇,并精确设计出在靶组织/靶器官环境中发挥作用的基因调控途径。然而,这项工作在各方面似乎都非常具有挑战性。
除了信号肽外,一些分泌系统,如沙门氏菌的 III 型分泌系统,也可以通过改造来分泌靶蛋白,甚至直接将这些治疗蛋白导入靶细胞。对于小分子化合物来说,要输送治疗化合物,就必须改造细菌原有的抗生素输送泵或转运蛋白。
用作药物载体的工程微生物主要是乳球菌、沙门氏菌和大肠杆菌。乳球菌是一种应用非常广泛的知名益生菌,研究人员在乳球菌的基因改造方面做了大量工作。沙门氏菌易于在肿瘤环境中定植,因此被用于在肿瘤内释放抗癌化合物。对大肠杆菌的研究也较多,因为它是基本的工程细菌底盘。其他菌株,如动物双歧杆菌、单核细胞增生李斯特菌、表皮葡萄球菌、卢格登葡萄球菌、产孢梭菌和一些酵母菌也很有前景。由于利用合成生物学改造细菌作为给药载体的研究并不成熟,目前还没有完善成熟的系统。
总之,利用合成细菌作为给药载体的研究仍处于起步阶段。目前,这些研究大多集中在靶细胞附近治疗蛋白的表达上,而小分子治疗化合物的输送还很少见。无论基于哪种微生物底盘,也无论要输送哪种化合物以实现诊断、治疗或预防功能,合理设计的工程细菌输送载体必须包含三个组成部分:信号输入、信号处理和整合,以及化合物输出。随着进一步的发展,在可预见的未来,这一系统无疑将变得更加复杂和精确,并可应用于预防、诊断和治疗等多个方面。
综合编译自Zhou, Y., & Han, Y. (2022). Engineered bacteria as drug delivery vehicles: principles and prospects.
Engineering Microbiology, 2(3), 100034.
来源:荣格-《国际医药商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。