荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
病毒样颗粒(Virus-like particles,VLP)是一种在治疗、免疫和诊断方面具有多种应用的纳米结构。随着生物医学工程技术的最新进展,不少基于 VLP 的疫苗已经面世,正被广泛用于对抗传染病,而更多的疫苗正处于临床研究的不同发展阶段。由于在有效性、安全性和多样性方面的理想特性,基于 VLP 的方法在未来几年可能会变得更加流行。同时,一些生产和制造的挑战必须解决。《国际医药商情》梳理了近年来基于 VLP 的疫苗的研究进展,介绍VLP 的特性、表达系统以及作为抗击新出现的致病性病原体的理想候选疫苗的潜在适用性。
一种革命的创新方法
现有的大多数疫苗主要基于灭活(杀死)或减毒活疫苗。虽然这些传统疫苗已经被有效地用于对抗各种传染病,但是其中一些疫苗存在不少局限性,包括其诱导更强免疫应答的潜力较低和效果较差等。新冠疫情表明,需要开发强有力的疫苗来克服这些限制。主要的挑战是开发新的技术方法,在不危及安全性、有效性和耐受性的情况下增强免疫力。基于 DNA、 mRNA 和重组病毒载体的疫苗的最新进展为难以靶向的病原体和控制传染病暴发提供了有效的疫苗开发方法。
而病毒样颗粒(VLP)技术为开发有效的疫苗以对抗严重关切的传染病提供了一个替代平台,其正在与基于 mRNA 和病毒载体的疫苗并行发展。与其他亚基疫苗相比,VLP 也更具免疫原性,因为它们在其表面呈现出重复的抗原表位,这是免疫系统容易检测到的更真实的证实。另一方面,亚单位疫苗由于靶抗原的错误折叠或对免疫系统呈递不足而具有较差的免疫原性。此外,其需要佐剂和重复剂量的疫苗接种,以引起足够的免疫应答。
两位生物化学家Fraenkel-Conrat 和 Williams 在1955年首次提出“病毒样颗粒”这一术语,他们从提纯的 RNA 和蛋白质组分中重组了烟草花叶病毒(TMV)颗粒。这些纳米结构诱导免疫应答的潜力后来被进一步研究。
这些生物激发的纳米结构具有来自不同强毒剂的重复的高密度抗原,有助于触发强烈的免疫应答。此外,这些高免疫原性分子具有病毒蛋白的自组装特性。其具有生物相容性,在合成过程中具有结构灵活性的潜力。此外也可以被化学或遗传修饰,并具有更高的稳定性,均匀性和功能性,这被认为是各种生物医学应用中的有效工具。根据有无脂膜,VLP可分为有包膜和无包膜两种。
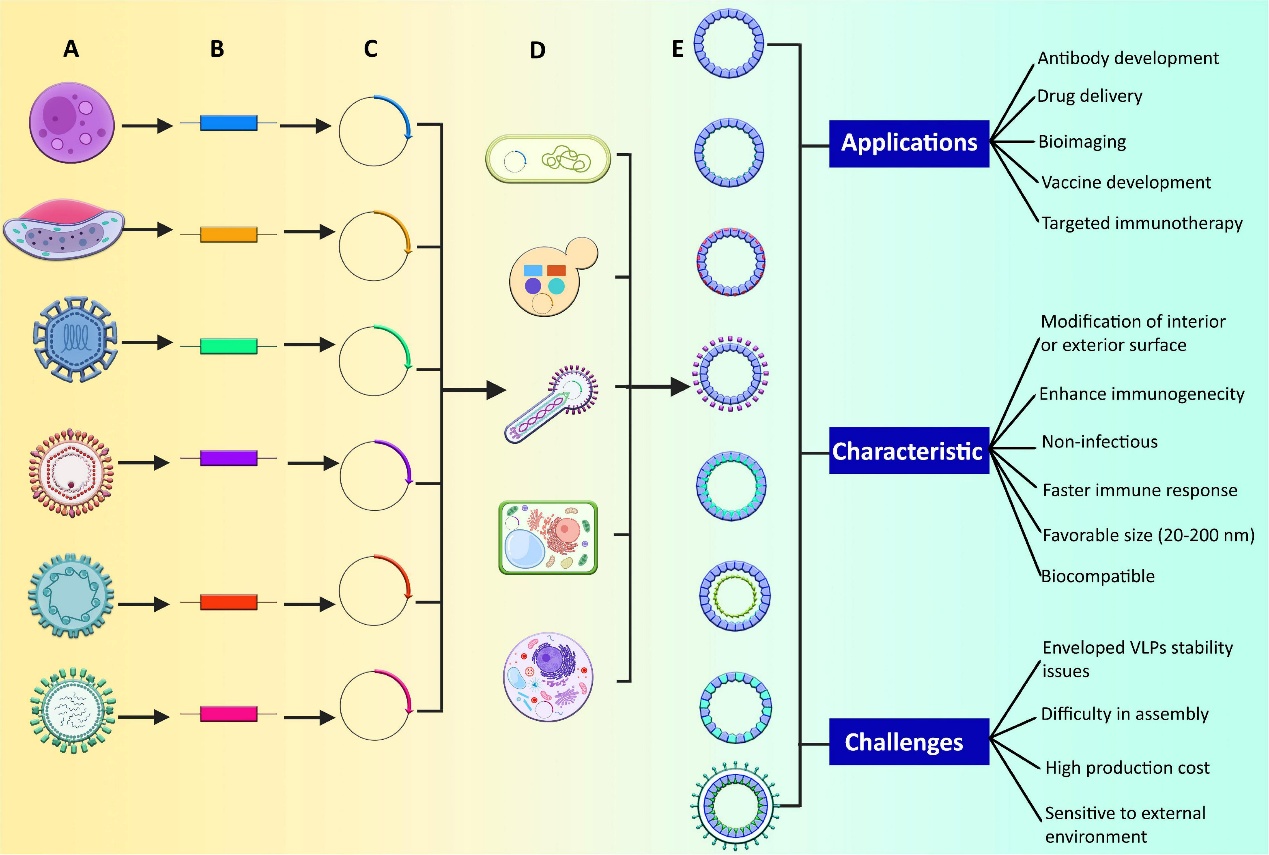
图1 :不同类型 VLP 的生产及其应用、特点和挑战——A、不同的人类致病病毒和寄生虫;B、确定构成病原体结构特征并可形成 VLP 的基因;C、将确定的基因纳入质粒等表达载体;D、允许载体在各种表达系统中表达;E、形成不同类型的 VLP,如包膜、无包膜和嵌合 VLP。无包膜 VLP 有两种类型:单蛋白或多蛋白。在多蛋白 VLP 中,可能有单层、多层,有些也有镶嵌层。嵌合 VLP 可以内部或外部修饰,也可以通过化学共轭进行修饰。
然而,VLP 也面临一些挑战,主要是稳定性较低、下游加工困难、生产成本高以及对环境条件敏感。在细菌、酵母、哺乳动物细胞、昆虫细胞和植物等各种表达系统(ES)中合成了许多不同的 VLP。基于 VLP 的疫苗可用于治疗各种传染病,包括艾滋病毒、流感、乙型肝炎、戊型肝炎、疟疾、埃博拉病毒、SARS-CoV-2、寨卡病毒、登革热和口蹄疫等。一些基于 VLP 的疫苗已经获得许可并在市场上上市,包括针对 HBV 的 Engerix-B®(葛兰素史克)和 Recombivax HB®(默克)、针对 HPV 的 Gardasil®(默克)和 Cervarix®(葛兰素史克)、针对 HEV 的 Hecolin®(厦门万泰沧海),以及Mosquirix™(葛兰素史克公司)抗击疟疾。
类病毒颗粒的特性
一般来说,VLP由于其独特的特性而成为有效疫苗的潜在候选者,是有效的免疫刺激分子,以适当的构象和高度重复的方式显示高密度的病毒表面蛋白,引起强烈的 T 细胞和 B 细胞获得性免疫应答。大多数 VLP来源于病毒外壳或包膜蛋白,尽管核心蛋白也可以使用。VLP天生具有生物相容性,不具有传染性,因为其缺乏病毒遗传物质,因此不能复制。VLP也被认为比常规减毒活疫苗更安全(不能恢复到野生型)。此外,VLP是高度灵活的分子,在其大小不同,大多数范围从20至200纳米。大小范围是最佳的,可以将它们自由排出至淋巴结,并更容易被抗原呈递细胞(APC),特别是树突状细胞(DC)摄取,然后通过抗原加工和主要组织相容性复合体(MHC)II 类分子呈递。VLP高度有组织,可以自组装成不同的几何对称,通常以二十面体,螺旋对称,棒状结构或球状形状的形式,具体取决于病毒的来源。
VLP可在多种 ES 中合成,包括原核(细菌)和真核(昆虫细胞、哺乳动物细胞系、植物细胞或酵母)。VLP的功能可以通过使用不同的方法,如肽共轭、基因融合和化学交联等,通过显示感兴趣的异源表位来修饰其外表面或内表面。VLP 技术具有显著优势,因为其是一种更快的疫苗合成方法。针对特定菌株的新型 VLP 疫苗可在菌株测序后 12-14 周内制备完成,而传统疫苗的生产过程通常需要 24-32 周。这些疫苗不含鸡蛋蛋白,这将大大减轻易过敏人群的负担,并能比传统疫苗提供更强的疾病保护。
VLP表达平台
基于 VLP 的疫苗已被开发为下一代疫苗。然而,为了确保最佳的蛋白质折叠、翻译后修饰(PTM)、成本效益以及及时扩大这些疫苗的生产规模,必须选择合适的平台。VLP 可在实验室利用重组病毒蛋白进行实验生成,重组病毒蛋白可在一系列表达系统中表达,包括原核细胞、酵母、昆虫细胞系、植物和哺乳动物细胞系。此外,无细胞表达技术也已成功应用。在这种情况下,VLP 蛋白首先在基于细胞的表达系统中表达,然后在无细胞环境中组装,以进行适当的折叠。
每种 VLP 的最佳表达方式通常是通过比较多种表达系统的翻译产物来试错确定的。在大肠杆菌中表达通常是生产具有有限 PTM 的小蛋白的首选;然而,具有 PTM 的大蛋白需要更复杂的表达系统,如酵母、杆状病毒和哺乳动物细胞。与高等真核生物相比,酵母被认为是一种具有成本效益的生产系统。此外,酵母还能避免细菌和哺乳动物表达系统带来的内毒素和病毒污染问题。Engerix-B(HBV 疫苗)和 Gardasil(人类乳头瘤病毒疫苗)是美国食品及药物管理局(FDA)批准的两种疫苗,都是在酵母表达系统中产生的。尽管取得了这些成就,但酵母缺乏复杂的 PTM 是其主要缺点,这限制了其在生成非包被 VLP 方面的应用。相比之下,动物细胞表达平台具有吸引力,因为其能够制造对蛋白质正常折叠至关重要的复杂而精确的 PTM,可用于生产非包膜和包膜 VLP 的多种结构蛋白。
由于基于杆状病毒的 VLP 表达简便快捷,该系统适用于生产流感病毒等表面抗原在爆发期间迅速变化的病毒疫苗。Cervarix 是美国FDA批准使用这种表达系统生产的人类乳头瘤病毒疫苗。杆状病毒/昆虫细胞平台还被用作预防多种传染病的候选疫苗,如HIV-1、甲型流感病毒、基孔肯雅病毒、严重急性呼吸系统综合征、埃博拉病毒、登革热病毒、裂谷热病毒、诺沃克病毒和丙型肝炎病毒。杆状病毒/昆虫细胞平台的主要缺点是其 N-糖基化模式比哺乳动物细胞的简单,这对于某些 VLP 应用来说可能是一个不利因素。
在转基因植物中生产 VLP 有几种值得关注的应用。例如,虽然植物细胞缺乏类似哺乳动物的 PTM,但植物特异性糖基化可产生免疫刺激作用。植物已被用于生产诺沃克病毒、HIV-1和流感病毒。最近开发的另一种表达平台是无细胞系统,通常由大肠杆菌或酵母细胞的提取物组成。该系统适用于生产具有毒性中间体形式的病毒帽蛋白。由于无细胞系统具有不可再生的特性,因此这种方法的要求很高,扩展性受到限制。无细胞表达系统生产的商业化 VLP 疫苗包括流感疫苗 Inflexal V和甲肝疫苗 Epaxal。
VLP 生产中的技术难题
转导相关参数
在杆状病毒系统中,感染时的细胞浓度(CCI)、感染倍率(MOI)和收获时间(TOH)对蛋白质的表达以及 VLP 的组装有很大影响。感染后 72-120 小时被认为是最佳收获时间。在此时间段之外,各种参数都会阻碍生产率,如细胞裂解、蛋白质降解,以及因存在杂质蛋白、宿主或病毒 DNA 而导致的下游处理困难。不完整的 VLP 也可能与目标成熟 VLP 一起释放到培养基中,阻碍 VLP 的下游处理。可以通过调节 CCI 来抵消由于低或高 MOI 造成的体积生产率差异。然而,CCI 与生产率成反比。虽然灌流或喂料批处理技术可以克服这些局限性,但它们既不实用也不经济。因此,需要开发新的工艺优化技术。
VLP 装配
VLP 的组装涉及在适当的生产宿主(体内组装)或无细胞条件(体外组装)下组装单个或多个结构帽蛋白。稳定接触的性质会影响 VLP 的组装路径。蛋白质与蛋白质之间的相互作用可保护病毒遗传物质不被降解,并有助于建立相对稳定的载体/递送系统。同样,病毒基因组与自身结构元素的共同进化导致了相互作用,其中核酸是 VLP 形成的主要驱动机制。例如,HCV VLP 的形成取决于核心蛋白的高碱性 N 端 120或 124个氨基酸与含有预期二级结构元素的5'非翻译区的相互作用。VLP 的组装和分解还可能取决于组装时的离子或还原条件。在更复杂的病毒中,支架蛋白在确保大型病毒正确组装方面发挥着重要的结构作用。例如,P22a 是单纯疱疹病毒粒子组装过程中的关键支架蛋白。组装通常不是单一的高阶反应,有时可能包括一连串的低阶中间反应。通过诱变结构蛋白并在合适的系统中表达,可以检查或捕获组装各阶段的这些中间反应。VLP的均匀性和自组装性,以及主要在外表面承受化学修饰的能力,使其成为脂质体和金属组装体等纳米粒子的灵活而稳定的替代品。
VLP的自组装是由囊膜蛋白之间的相互作用以及通常与病毒基因组的相互作用驱动的。例如,RTS,S(Mosquirix™;第一种疟疾疫苗)中约 25% 的 HBsAg 单体与截短的环孢子虫蛋白 (CSP) 基因融合,成为蛋白载体。RTS,S疫苗中的CSP区域包括免疫显性B细胞表位(最后18个4氨基酸(NANP)重复序列)和三个已知的T细胞表位:在类血栓蛋白(TSP)结构域之前的一个高度可变的CD4+T细胞表位,类血栓蛋白结构域内的一个高度可变的CD8+T细胞表位,以及C末端的一个保守的“通用”CD4+T细胞表位。Mosquirix的这些表位增强了免疫系统的抗原呈递能力,并可能促进接种者产生强烈的抗CSP抗体和T细胞反应。Mosquirix 已获得监管机构的批准。
为了获得优异的组装效果,无细胞或体外组装 VLPs 需要控制温度、pH 值和特定组装溶液等变量。在体内组装 VLP 需要为宿主提供合适的热力学环境,这可能会导致形成畸形结构,给 VLP 组装和生产带来技术挑战。在这种情况下,热力学研究可能有助于确定上游加工过程中最合适的生产环境条件,以及在下游加工(DSP)和储存过程中保持稳定性。多项研究表明,一些物理化学参数(pH 值、离子强度、温度和正确的化学计量比)对 VLP 的形成有影响。当不具备最佳条件时,VLP 的破坏会大大增加。此外,由于其结构庞大,VLP 有时会失去自组装特性或导致蛋白质错误折叠,从而形成有缺陷的 VLP。时间是使抗原组装费力的另一个因素。因此,优化对适当的 VLP 组装至关重要,应进一步研究。
上游处理
一些工艺参数,如溶解氧浓度、pH 值、温度、搅拌速率、入口气体流量和成分,会影响 VLP 的生产,并通过阻碍细胞生长或细胞代谢状态或干扰负责翻译后修饰的机制而带来技术挑战。有限或过量的氧气会诱导蛋白酶,从而降解相关产物。当溶解氧浓度过高而形成氧自由基时,它们会诱发细胞氧化应激或导致蛋白质氧化损伤。温度是另一个可以控制氧溶解度的参数。
根据细胞的敏感程度,使用顶空曝气(无泡系统)或非离子共聚物可能是一种解决方案。在无泡系统中可以消除细胞损伤,但由于溶解氧水平不足,生产率会下降。然而,非离子共聚物不会干扰溶解氧。这些共聚物可降低培养基的表面张力,增加细胞膜的硬度,从而抑制细胞附着在气泡上,增加细胞对流体动力的抵抗力。
VLP 下游加工
利用转导技术从 VLP 中分离复杂的蛋白质混合物具有挑战性,因为它们的大小和分子量相似。转染则不存在同样的问题,因此大大降低了下游处理的复杂性。由于无血清培养基不含任何动物源性补充剂,因此可进一步改善或促进下游处理过程。控制各种工艺条件,如最佳盐浓度、pH 值和离子浓度,可以减少或避免蛋白质聚集,这是下游加工过程中的一大挑战。然而,在大规模生产 VLPs 的过程中,由于 VLPs 的体积较大,其聚集会导致目标蛋白质的大部分损失或免疫原性降低。在最近的一项研究中,开发了一种新的膜层析程序来生产抗埃博拉病毒的纳米 VLP。这种方法可将 VLP 的大小减小到更易于管理的范围,不仅能保持其温度稳定性和抗原结构,还能激发小鼠的免疫力。此外,冻干还可用于提高其恒温性。冻干和冷冻干燥技术已在全球范围内得到广泛应用。不过,它们对没有可靠冷藏冷链的热带国家尤为有效。2015 年,针对埃博拉病毒的方法申请了专利,但在 2017 年被放弃。切向流过滤、凝胶渗透、离子交换、尺寸排阻色谱和混合模式色谱,包括使用改进的一次性膜技术,可以提高纯化 VLP 的生产率。
生物化学和生物物理特征描述
通常采用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳、蛋白质印迹法(WB)、酶联免疫测定(ELISA)和双喹啉酸(BCA)蛋白质定量测定等多种技术对 VLP 进行生化鉴定。流式细胞术目前已被用作研究和验证 VLP 的工具。然而,这些技术无法区分未组装和部分或完全组装的 VLP,而且耗时长、灵敏度低、样品量要求高。这会导致蛋白质含量过高或过低,影响下游处理。透射电子显微镜(TEM)可以有效地观察和解决上述一些问题。通常采用光散射技术进行粒度分析,以测量溶液中 VLP 的流体力学粒度和均匀性(多分散性)。此外,为了克服 SDS-PAGE、WB、ELISA 等方法的局限性,还开发了一些正交方法,如高效液相色谱法(HPLC)、SDS-毛细管凝胶电泳法、MALDI-TOF MS 和毛细管区带电泳法。二维荧光测定法是一种基于光纤的技术,可以监测存在于细胞外或细胞内的多种化合物。利用这种技术可以对 VLPs 的动力学进行原位监测。
VLP的前路
目前,由于开发过程中的各种障碍,只有少数基于 VLP 的疫苗可以商业化,用于预防各种病原体,如寨卡病毒、丙型肝炎病毒、乙型肝炎病毒和人乳头瘤病毒。因此,必须解决这些障碍,以促进商业化。研究人员正试图通过选择适当的佐剂和稳定剂/保护剂、给药途径和输送载体(如脂质体、聚乳酸-共聚乙二醇微粒或藻酸盐),在配方层面完善基于 VLP 的疫苗,以减少疫苗注射次数和剂量。同时,提高疫苗保质期和避免冷链的方法也在研究之中。
从经济角度来看,Gardasil9是最成功的基于 VLP 的疫苗,2021 年的收益超过 487 亿美元。Gardasil9已被Gardasil9取代,后者是一种佐剂非感染性重组 9 价疫苗。与Gardasil相比,Gardasil9 增加了人乳头瘤病毒 16 和 18 的 L1 VLP浓度,以诱导抗体反应。L1 是一种约 55 kDa 的蛋白质,能够自发地自我组装成 VLP。
相应的,在过去三年中产生的其他基于 VLP 的疫苗中,如用于 HPV 的 Cervarix 和用于 HBV 的 Engerix-B、Recombivax HB 和 Hepavax-Gene,还没有关于收入的报道。Cervarix 含有两种人类乳头瘤病毒(16 型和 18 型)的纯化蛋白,该疫苗使用单磷脂 A(MPL)制成,MPL 是一种从细菌中提取的纯化脂质(类脂物质),可增强疫苗的免疫反应。然后将 VLP 和 MPL 固定在铝化合物上,以激发更好的免疫反应。MPL 是具有 4'-phophoryl 基团和不同数量酰基链的同源脂质 A 的异质混合物。MPL 佐剂以 AS04 的形式模拟 Toll 样受体 4 激动剂,可直接刺激抗原呈递细胞,产生明显的细胞和体液免疫反应以及持久的抗体反应。Engerix-B 和 Recombivax 疫苗的区别仅在于 HBsAg 的浓度和铝佐剂的性质。Engerix-B 使用氢氧化铝作为佐剂,并在生产过程中使用微量硫柳汞(182)。另一方面,Recombivax 含有硫酸氢化磷酸铝。
目前,学术界和工业界合作伙伴都在合作生产中低收入国家负担得起的廉价疫苗。然而,根据以往的情况(如乙型肝炎病毒疫苗接种),这种情况似乎从未发生过。例如,人乳头瘤病毒 VLP Gardasil和宫颈癌疫苗(Cervarix)等挽救生命的疫苗,最初是以相对较高的价格在工业化国家和发展中国家的私营部门推出的。因此,向低收入和中等收入国家提供这些疫苗所花费的时间比预期的要长。生物制药公司的财务可行性是这一过程中的主要障碍,需要加以解决。
来源:荣格-《国际医药商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。