荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
在happi China六月刊上,深入探讨一种简单糖基成分对皮肤保湿影响的一篇文章中,详细介绍了实验方法,以及一些初步的结果,分析了保湿相关基因在人体重建表皮三维模型中的表达,神经酰胺在人体正常皮肤外植体的合成情况,以及透明质酸在正常人体角质形成细胞和真皮成纤维细胞中的含量。此外,临床试验对比了3% XAX乳液和安慰剂乳液对人体皮肤水合作用的影响。在本期配料栏目中,我们将继续揭晓剩下的结果,详细探讨纤维母细胞和角质形成细胞产生的关键蛋白的评估,以及这种新成分对体内皮肤水合作用的影响。还将展开关于这些结果的讨论,最后得出结论。相信通过这项详实的研究,读者将能更深入地理解这种简单糖基成分对皮肤保湿的重要作用。
(上接6月刊P40)
3. 纤维母细胞和角质形成细胞产生的关键蛋白的评估
用原代细胞培养研究XAX或甘油的作用。
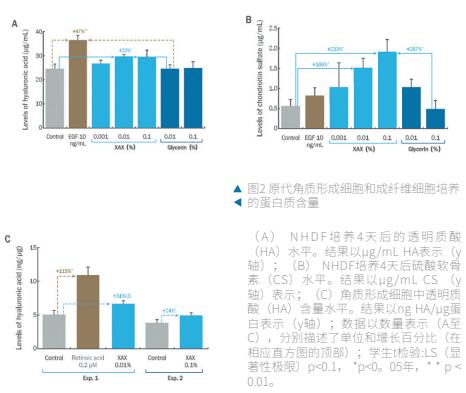
(1)正常人真皮成纤维细胞培养中透明质酸和硫酸软骨素的产生
EGF在10 ng/mL的培养基中检测,与未处理的细胞相比,细胞外HA含量增加了47% (p<0.01;图2A)。0.01%和0.1%浓度的XAX与未处理的细胞相比,细胞外HA含量分别增加了20%(p<0.05)和19%(p<0.1),而最低浓度0.001%的XAX对细胞外HA含量无显著影响(图2A)。
此外,当以0.01%测试时,XAX与甘油0.01%(+20%;P <0.05),与甘油0.1%(+19%;p = 0.05;图2A),XAX显示具有统计上显著的促进作用。甘油,也在0.01%和0.1%测试,对细胞外透明质酸含量没有影响(图2A)。
观察CS含量,在10 ng/mL浓度下,EGF在CS中的细胞外含量增加了45%(图2B;与未处理的细胞相比无显著影响)。XAX,检测浓度为0.001%、0.01%和0.1%,与未处理的细胞相比,CS细胞外含量增加,呈剂量依赖性(分别为+80%、+166%和+233%)。 在两个最高浓度的XAX中,这些增加具有统计学意义(p<0.05)(图2B)。与甘油0.1%处理的细胞相比,0.1%浓度的XAX也增加了CS细胞外含量(+287%,p<0.05;图2B)。0.01%和0.1%的甘油对CS细胞外含量没有显著影响(图2B)。
(2)正常人体表皮角质形成细胞中透明质酸的产生
在0.2μM时,视黄酸能使HA含量提高115% (p<0.05;图2C)。在0.01%和0.1%时,XAX也能使HA的产生和分泌分别增加31% (p<0.1)和24% (p<0.05)(图2C)。
4. 对体内皮肤水合作用的影响
(1) 在常规的身体护理乳液中使用时对身体的影响
XAX改善表皮微观纹理和增加皮肤电容,同时减少经皮失水(TEWL)。XAX诱导皮肤微观纹理和脱屑的改善,分别为+33% (p<0.1)(图3A)和+25% (p<0.1);图3B),治疗30天后。其中一名志愿者的典型照片可以在显微镜下清楚地观察到这种影响(图3A和3B;右侧部分)。
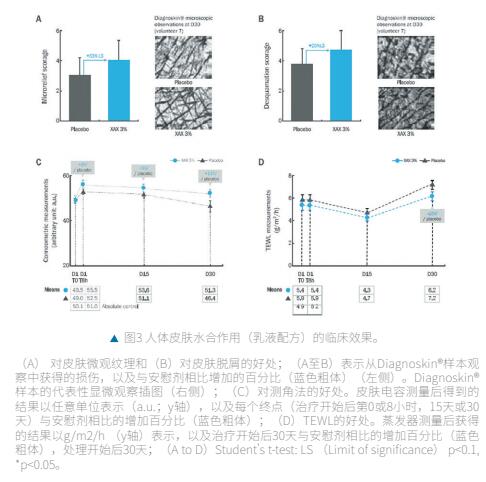
在治疗后8小时、15天和30天,皮肤水合度(角膜测量)也有统计学意义的显著增加(分别为+6%、+5%和+11%;图3C)。最后,XAX还在治疗后8小时、15天和30天改善皮肤屏障功能(TEWL降低)(8小时和15天-8%,30天-15%;图3D)。这种效果在治疗结束时具有统计学意义。
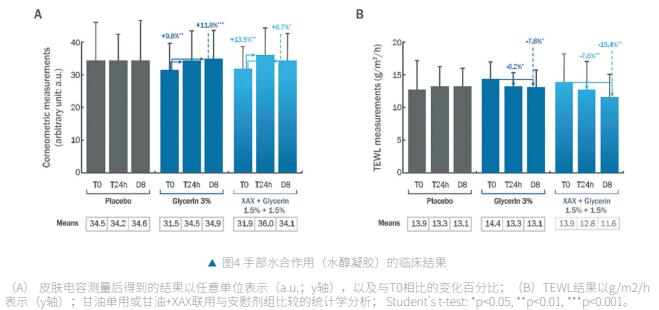
(2) 在水醇凝胶中使用时对手的影响
含1.5% XAX+1.5%甘油的配方具有显著的短期保湿效果,24 h后皮肤电容较D0增加13.5%(p<0.01);图4A和较安慰剂增加+ 13.8%。90%的志愿者觉得他们的手滋润了,95%的人觉得他们的皮肤更舒适了。 甘油含量为3%的配方也表现出立即显著的保湿效果,皮肤电容比D0增加了9.8%(p<0.01);图4A和+11.2%与安慰剂相比。和之前的配方一样,90%的志愿者觉得他们的手保湿了,95%的人觉得他们的皮肤更舒适了。同时,安慰剂组在皮肤保湿方面没有观察到任何改善(图4A)。
从长期来看,含有1.5% XAX+1.5%甘油的配方也能改善皮肤屏障功能,8天后经皮失水显著减少-15.4% (p<0.01);图4B),与安慰剂相比减少了-11.2%。95%的志愿者感觉自己的手保湿了,100%的人感觉皮肤更舒适了。含有3%甘油的配方也表现出长期水合效果,8天后经皮失水显著减少-7.8%(p<0.05;图4B),但与安慰剂相比无显著效果(-3.2%)。95%的志愿者感觉他们的手保湿了,100%的人感觉他们的皮肤更舒适了。同时,安慰剂组在皮肤屏障功能方面未见改善(图4B)。
讨论
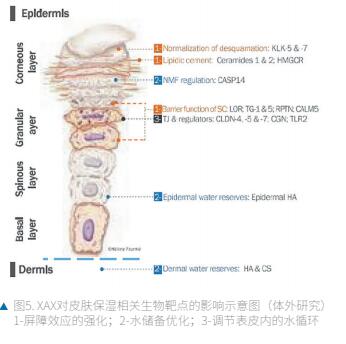
皮肤屏障功能对人体的生存至关重要,皮肤水合作用对维持皮肤健康至关重要。因此,保湿剂是最常用的护肤成分,通常由皮肤科医生开处方。它们中的大多数起润肤剂、润湿剂(如甘油)或封闭剂的作用,而其他的则是模仿或促进皮肤天然成分的产生,如透明质酸(HA)。在本研究中,研究了一种特殊的糖基结构,即XAX(INCI: 木糖醇基葡糖苷-脱水木糖醇-木糖醇),在体外和体内对皮肤屏障功能和保湿作用进行了研究。在体内,在有或没有甘油的情况下,在水和水醇配方中,有多个测量参数,并得到完整的生物学作用模式的支持,观察到了可靠的结果。
1.作用方式
(1) 促进皮肤屏障功能
首先,结果表明,局部应用XAX可促进人皮肤外植体模型中表皮神经酰胺的新合成,其效果优于安慰剂配方。SC神经酰胺是SC脂质的主要成分。
这些脂质成分赋予角化层防水性能,并通过角膜桥粒紧密连接,确保了角化包膜的物理强度和机械阻力。除了SC基质的游离脂质外,还有与角质层蛋白包膜共价结合的神经酰胺。有观察到神经酰胺含量在干燥皮肤上减少,如特应性皮肤中(Hogan et al. , 2012)。因此,XAX对SC神经酰胺产生的促进作用肯定有助于其在体内观察到的保湿作用。在重建的表皮模型中,XAX还诱导3-羟基-3-甲基戊二酰辅酶a还原酶(HMGCR)基因表达增加,HMGCR是胆固醇生物合成途径的关键酶(Faulkner & Jo, 2022)。由于神经酰胺和胆固醇是SC脂质的主要成分,在一些临床试验中,XAX预防TEWL的能力肯定与其对这两类表皮脂质的促进作用有关。从这些初步结果可以得出结论,XAX可以调节SC和表皮的脂质组成,从而可能参与皮肤屏障功能的增强。
此外,XAX对基因表达的影响,其对应的编码蛋白是角质层的酶或结构成分,以及脱屑过程的调节因子,可能进一步参与体内观察到的皮肤屏障功能的增加。 事实上,通过对局部处理的人重建表皮的RT-qPCR研究评估,XAX调控的基因包括ML5、CDSN、IVL、LOR、RPTN、TGM-1和-5,以及KLK5和KLK7。
ivl、lor和rptn基因属于表皮分化复合体(Epidermal Differentiation Complex, EDC),参与角化包膜的形成。更具体地说,转谷氨酰胺酶-1(TGM1)交联IVL、LOR和其他结构蛋白,以形成角化包膜,并提供SC的机械强度。在角化前不久,颗粒层的角化细胞合成并向细胞外空间分泌糖蛋白CDSN,该糖蛋白自发地嵌入由钙粘蛋白占据的SG桥粒的细胞间部分(Haftek, 2015)。在脱屑过程中,CDSN必须被蛋白酶和桥粒钙粘蛋白降解。丝氨酸蛋白酶(钾溶酶,KLK)和半胱氨酸蛋白酶(组织蛋白酶)及其各自抑制剂的复杂相互作用是通过SC pH和水合作用的改变来协调的,从而导致角质桥粒的逐渐消化(Haftek , 2015; Mc Govern et al. ,2017)。
综上所述,这些结果证实了XAX调节了几个基因,并支持了它发挥广泛生物效应的概念,与表皮主要蛋白质和脂质成分的产生一致,它们本身对皮肤水合作用至关重要。
(2) 促进皮肤水分储备
XAX除了对SC结构和皮肤屏障功能相关的生物学靶点有影响外,还能诱导正常人真皮成纤维细胞和正常人角质形成细胞中HA含量的增加。在tubo酶分析中还强调,与对照条件相比,0.01%和0.05%的XAX测试显著抑制透明质酸酶活性,而在相同条件和相同剂量下测试的甘油没有影响(数据未显示)。此外,XAX处理的正常人真皮成纤维细胞显示CS的产生增加。可电离基团(己醛酸上的硫酸盐和羧酸)的存在赋予了GAGs如保水性等关键能力 (Sodhi & Panitch, 2021)。与透明质酸类似,当CS与蛋白聚糖(如聚集蛋白)结合时,它能促进保水性。
在表皮层,天然保湿因子(NMF)充当水库。事实上,它们的主要功能实际上不是增加水分含量,而是在脱水条件取代水分, 从而保持SC 脂质和蛋白质成分的流动性(Mojumdar et al., 2017)。NMF的氨基酸部分来自FLG的降解。更准确地说,Capase-14 (CASP14)参与了聚丝蛋白原裂解成FLG单位,FLG单位可以整合到角蛋白中间丝(KIF)中以稳定和改变细胞的形状。这种交联反应也由谷氨酰胺转胺酶催化,它参与了角化包膜正确成熟和功能的微调 (Goleva etal., 2019)。因此,XAX可以调节参与皮肤水分储备的表皮和真皮成分的表达。
(3) 促进水循环
在表皮内部,紧密连接(TJ)参与水分的输送。TJ构成细胞-细胞密封。在正常人类皮肤中,它们对表皮细胞的分化和角化至关重要。 TJ在表皮选择性渗透性、控制细胞间物质流动中起重要作用。 紧密连接蛋白 (CLDN),闭合蛋白, 闭合带 (ZO),扣带蛋白 (CGN) 和多PDZ域蛋白1 (MUPP-1) 定位于SG的细胞间边界,并与TJ的屏障功能有关 (Crawford &Dagnino, 2017)。
在局部处理的重建人表皮上进行的RT-qPCR实验表明,XAX能够提高几个编码TJ的基因的表达水平,特别是CCN蛋白、CLDN-4蛋白、CLDN-5蛋白和CLDN-7蛋白。 CGN是一种外周膜蛋白,在紧密连接斑块处与ZO-1结合。该蛋白在SG中表达 (Shi et al. , 2018) 同时扮演着结构和信号的角色(Crawford & Dagnino, 2017)。CGN介导的微管的锚定和组织需要该蛋白在TJ位点的磷酸化,进一步说明了CGN作为信号中枢的重要性。CLDN属于一个超家族,目前在人类/哺乳动物中由27个小的跨膜蛋白组成。它们通过细胞旁通路通过大小和电荷选择调节电导。根据其表达是否增加或减少渗透性,一般将单独的claudin蛋白分为屏障形成或孔形成(通道形成)Claudin蛋白(Shi et al., 2018)。例如,CLDN1和4被归类为屏障CLDN (Shi et al., 2018)。
在同样的RTqPCR实验中,XAX处理也增加了TLR2的基因表达水平。不同的研究报告了toll样受体(TLR)和TJ功能之间的联系。TLR是众所周知的作为先天受体的跨膜蛋白。表皮角质形成细胞表达多种TLR,它们位于细胞表面(TLR1、TLR2、TLR4、TLR5和TLR6)或内体(TLR3、TLR7和TLR9)。 (Sun et al. ,2019)
TLR2的激活增强了人体皮肤的屏障功能,是伤口修复反应的重要组成部分 (Kuo et al., 2013)。相反,在特应性患者中观察到的表皮TLR2表达降低可能与皮肤屏障功能不全有关(Kuo et al. , 2013) ,有报道称TLR的基因变异与这种疾病有关 (Zaniboni et al., 2016). 此外,激活TLR2可以调节TJ蛋白的表达 (Zaniboni et al., 2016; Kuo et al., 2013). 综上所述,这些结果表明XAX可能通过促进TJ关键成分的表达以及TLR2诱导的相关调节机制来调节TJ的功能。
因此,通过作用于TJ和TLR2的表达,XAX作为参与细胞旁水循环的生物途径的调节剂出现。
XAX对表皮和真皮层产生皮肤水分储备和加强皮肤屏障的生物效应最有可能是其促进皮肤电容,同时减少TEWL的能力的起源。事实上,我们的身体由大约70%的水组成,其中20%积聚在皮肤上。在这种特定的界面组织中,60-70%的水分位于真皮层内(Guzman- Alonso & Cortazar, 2016),表皮从真皮层吸收水分。皮肤的机械性能,在强度和弹性方面,已知受到水合作用的影响,而SC中的含水量确实是支配其柔韧性的主要因素 (Mojumdar et al., 2017)。因此,在皮肤微观纹理以及皮肤表面方面所观察到的益处也肯定是由于XAX对SC功能、水分储备和循环的整体生物作用。
2. 促进体内皮肤水合作用
如前所述,市场上的大多数保湿产品都使用润肤剂、润湿剂和具有闭塞性的成分。甘油是一种具有吸湿特性的成分:它“捕获”水分子。因此,它在世界各地的化妆品中被广泛使用。考虑到甘油的广泛使用,以及最近的流行病导致大量使用含有高浓度醇(乙醇、异丙醇)的手部消毒剂凝胶,评估XAX在这种与甘油相关的极具挑战性的水醇制剂中的益处似乎很有意义。与安慰剂相比,含有1.5% XAX+1.5%甘油的配方具有即时保湿效果,24小时后皮肤电容显著增加;与安慰剂相比,长期效果较好,8天后TEWL显著降低,效果优于单独含有3%甘油的配方。
此外,志愿者对保湿感觉和舒适度的满意度较高,两种配方的满意度相同。结果表明,XAX可以提供水醇凝胶在皮肤屏障功能、水合作用和舒适性方面具有一定的保护作用。上述生物效应可以解释XAX的保湿效果优于甘油的吸湿性。事实上,在不同的体外实验中,甘油对以下生物靶点没有影响被证实:表皮神经酰胺的新合成,成纤维细胞中细胞外透明质酸和硫酸软骨素的含量,以及透明质酸酶的活性(数据未显示)。 在未来,可以在生物和化学水平上进一步研究和比较XAX和甘油之间的协同效应。比较XAX与甘油的相互作用对外植体或重建表皮全基因组表达的影响是非常有意义的。
结论
总之,XAX证明了它在皮肤保湿方面的好处。首先,在体外,它可以作用于表皮和真皮水合作用的三个主要生物学途径(图5):表皮分化与皮肤屏障功能;皮肤水分储备(包括表皮和真皮层);表皮内的细胞旁水循环。其次,在体内,其对皮肤的保湿和保护作用在标准保湿方案和常规干燥皮肤上以3%的剂量得到证实。在严格的使用条件下,将水醇凝胶与甘油结合使用时,还观察到有趣的效果。综上所述,这些结果证实并加强了XAX作为一种强大的保湿化妆品成分,提出了与基础润肤剂,润湿剂和封闭剂结合的替代品或有趣的效果。
作者:应用研究主任Christine Garcia博士、高级研究员Elodie Valin博士、研究员Elsa Hernandez医学博士、
生物评估经理Catherine Kern博士、科学传播经理Alicia Roso硕士,Seppic 巴黎研究与创新中心
参考文献:
• Crawford M, Dagnino L. Scaffolding proteins in thedevelopment and maintenance of the epidermal permeability barrier. Tissue Barriers, 5: e1341969, 2017.
• Draelos ZD. The science behind skin care: moisturizers.Journal of Cosmetic Dermatology, 17: 138–144, 2018
• Faulkner R, Jo Y. Synthesis, function, and regulation ofsterol and nonsterol isoprenoids. Frontiers in Molecular Biosciences, 9: 1006822, 2022.
• Goleva E, Berdyshev E, Leung DY. Epithelial barrier repair and prevention of allergy. Journal of Clinical Investigation, 129:1463–1474, 2019.
• Guzman-Alonso M, Cortazar TM. Water content at different skin depths and the influence of moisturizing formulations.Household and Personal Care Today, 11: 35–40, 2016.
• Haftek M. Epidermal barrier disorders and corneodesmosome defects. Cell and Tissue Research, 360: 483–490, 2015.
• Henry J, Toulza E, Hsu CY, Pellerin L, Balica S, Mazereeuw-Hautier J, Paul C, Serre G, Jonca N, Simon M. Update on the epidermal differentiation complex. Frontiers in Bioscience, 17: 1517–1532, 2012.
• Hogan MB, Peele K, Wilson NW. Skin barrier function and its importance at the start of the atopic march. Journal of Allergy, 2012: 901940, 2012.
• Jemec GBE, Na R. Hydration and plasticity following long-term use of a moisturizer: a single-blind study. Acta Dermato-Venereologica, 82: 322–324, 2002.
• Kuo IH, Carpenter-Mendini A, Yoshida T, McGirt LY, Ivanov AI,Barnes KC, Gallo RL, Borkowski AW, Yamasaki K, Leung Y.Activation of epidermal toll-like receptor 2 enhances tight junction function: implications for atopic dermatitis and skin barrier repair. Journal of Investigative Dermatology,133: 988–998, 2013.
• Lefèvre-Utile A, Braun C, Haftek M, Aubin F. Five functional aspects of the epidermal barrier. International Journal of Molecular Sciences, 22: 11676, 2021.
• Mc Govern JA, Meinert C, de Veer SJ, Hollier BG, Parker TJ,Upton Z. Attenuated kallikrein-related peptidase activity disrupts desquamation and leads to stratum corneum thickening in human skin equivalent models. British Journal of Dermatology, 176: 145–158, 2017.
• Mojumdar E. H, Pham Q. D, Topgaard D, Sparr E. Skin hydration: interplay between molecular dynamics,
• structure and water uptake in the stratum corneum.Nature Scientific Reports, 15712: 1–13, 2017.
• Shi J, Barakat M, Chen D, Chen L. Bicellular tight junctions and wound healing. International Journal of MolecularSciences, 19: 3862, 2018.
• Sodhi H, Panitch A. Glycosaminoglycans in tissue engineering:a review. Biomolecules, 11: 29, 2021.
• Sun BK, Boxer LD, Ransohoff JD, Siprashvili Z, Qu K, Lopez-Pajares V, Hollmig ST, Khavari PA. CALML5 is a ZNF750-and TINCR-induced protein that binds stratifin to regulate epidermal differentiation. Genes and Development, 29:2225–2230, 2015.
• Sun L, Liu W, Zhang LJ. The role of toll-like receptors in skin host defense, psoriasis, and atopic dermatitis. Journal of Immunology Research, 2019: 1824624, 2019.
• Zaniboni MC, Samorano LP, Orfali RL, Aoki V. Skin barrier in atopic dermatitis: beyond filaggrin. Anais Brasileiros De Dermatologia, 91: 472–478, 2016.
来源:荣格-《国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。