荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
前言
随着岁月流逝,我们身体的许多组织和器官都会发生有机变化,其功能会随着衰老而下降。皮肤是人体最大的再生器官,约占体重的 16%,通过将其与外界隔离来保护个体的生命。皮肤由表皮、真皮和皮下脂肪组织组成,并有毛囊、汗腺等附属物。在表皮中,角质形成细胞不断进行新陈代谢,而毛囊则进行周期性再生,并且在每个毛发周期中都会更新许多细胞。存在于皮肤组织中的干细胞是维持皮肤新陈代谢和稳态的关键要素[1]。干细胞的自我更新和分化能力受其所处环境(生态位niche)的影响[2]。对驻留干细胞的生态位研究表明跨膜胶原蛋白COL17,介导干细胞与周围细胞和基质之间的相互作用,以调节皮肤稳态、衰老和伤口修复[3,4]。本文将简单归纳介绍胶原蛋白COL17A1及其发现过程,重点介绍COL17 对表皮干细胞 (ESCs)、毛囊干细胞 (HFSCs) 和黑素细胞干细胞 (MSCs) 的干细胞生态位的影响及其在皮肤老化过程中的作用,进而展望干细胞老化研究成果在美容与抗衰老化妆品领域的应用前景。
胶原蛋白、XVII型胶原蛋白COL17及编码基因COL17A1
衰老不仅伴随着皮肤胶原蛋白老化流失导致的皮肤弹性下降、皱纹和下垂,头发也会变得脆弱、暗淡和稀疏。白发和脱发是人类最明显的衰老变化,而导致这种变化的部分原因也与胶原蛋白有关。
胶原蛋白 (collagen)[5] 是人体的一种非常重要的结构蛋白质。主要分布于细胞外基质(extracellular matrix, ECM),为结缔组织的主要物质基础。迄今为止,人类体内已知的胶原蛋白共有29种。其分类是基于分布部位、结构及功能的差异。皮肤中的9种胶原蛋白中,Ⅰ型作为一种纤维状胶原蛋白形成的胶原纤维约占人体中所有胶原蛋白的 90%。Ⅳ型和Ⅶ型是非纤维状胶原蛋白,存在于基底膜。这3种胶原蛋白都是保持肌肤韧性和弹性所必需的。
胶原蛋白的主要氨基酸序列是甘氨酸-脯氨酸-X或甘氨酸-X-羟脯氨酸。X 可以是其他17种氨基酸中的任何一种,每隔3个氨基酸就是甘氨酸。胶原蛋白由3条多肽链组成。多肽链缠绕在一起形成三重螺旋。由于甘氨酸是所有氨基酸中最小的,它可以使链条形成紧密的构型,并且可以承受压力。三螺旋结构赋予天然胶原蛋白较强抗降解能力,是其在人体内正常发挥作用的基础。
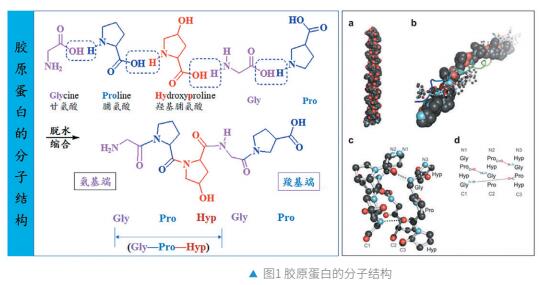
胶原蛋白的合成过程主要发生在成纤维细胞中。成纤维细胞是一种特化细胞,其主要功能是合成胶原蛋白和基质。 胶原蛋白的合成发生在细胞内及细胞外。 尽管不同类型的胶原蛋白可能会经历不同的翻译后修饰,但胶原蛋白的生物合成过程基本相同。
胶原蛋白生物合成始于细胞内细胞核中遗传信息的转录,随后mRNA转录物离开细胞核并进入内质网 (ER),在那里遗传信息被翻译表达为胶原蛋白多肽链。转录受到多种因素的调控,包括转录因子、表观遗传修饰、mRNA等。合成好的 α 肽链会进行翻译后修饰。首先,使用信号肽酶切断信号肽,接下来在赖氨酸羟化酶、脯氨酰4-羟化酶和脯氨酰3-羟化酶的参与下发生Lys和Pro羟基化。羟基化是胶原蛋白合成中最重要的修饰,需要适当的环境反应,如需要维生素C作为辅酶、需要提供分子氧、铁离子 (II) 和 α-酮戊二酸等。由于翻译后修饰可产生氢键来稳定该蛋白质的空间结构 (图1-d),可以增加胶原蛋白分子的稳定性和抗拉伸强度。
翻译后修饰的最后一步是糖基化。糖基化是在胶原蛋白多肽链上添加糖类分子,该反应在葡萄糖基转移酶和半乳糖基转移酶存在的情况下发生,可以影响胶原蛋白分子的折叠、交联和分泌。在胶原蛋白多肽链上形成的二硫键,可以促进胶原蛋白分子的形成三维结构。胶原蛋白多肽链在高尔基体中进行进一步的修饰和包装,会形成具有三螺旋结构的“前胶原”,然后通过囊泡运输到细胞外空间ECM。在ECM中,使用N蛋白酶和C蛋白酶去除末端前肽并形成成熟的胶原蛋白单体原胶原。原胶原序列中所含有的羟赖氨酸和羟脯氨酸侧链在酶作用下氧化生成醛,相互之间发生羟醛缩合反应形成原胶原之间的共价链接,形成胶原原纤维。胶原原纤维是胶原蛋白生物合成的最后阶段。胶原蛋白单体之间通过共价键或非共价键相互交联,形成不同类型和结构的胶原蛋白纤维或网络。
胶原蛋白在体内的生物降解是一个复杂的过程,可分为细胞外和细胞内两种类型。细胞内生物降解发生在自噬过程中,而细胞外生物降解则发生在细胞外基质金属蛋白酶 (MMP) 的作用下。在它们被激活后,三螺旋空间结构通过氨基酸对之间的肽键降解被破坏。人体胶原蛋白的合成取决于体质,但也受环境因素的制约。 例如,机械应力可以刺激胶原蛋白前体的合成等(前胶原蛋白)。
胶原蛋白作为天然大分子材料,在功效护肤、医用敷料、医疗美容等领域均具备良好的应用前景、市场空间广阔。受益于近年来美丽经济的快速发展,胶原蛋白市场亦快速扩容,2021 年行业终端市场规模已达288亿元(对应 2017-2021 年 CAGR 为 31%);长期来看,重组胶原蛋白有望实现供给突破,推动行业步入供需共振的景气度、加速上行阶段,预计 2027 年行业终端市场规模或突破 1700 亿元(对应 2022-2027 年 CAGR 为 34%)。[6]
XVII型胶原蛋白(COL17)的发现与水疱性皮肤病大疱性类天疱疮 (BP) 的研究有关。[4] 半个多世纪前,研究人员开始表征包括皮肤在内的组织的超微结构。 电子显微镜 (EM) 显示真皮-表皮交界处 (DEJ) 和表皮基底膜区 (BMZ) 具有多种结构成分,包括:半桥粒(内斑和外斑)、透明层、致密层和锚定原纤维。在1960年代和70年代开发了免疫荧光技术,来揭示免疫球蛋白在人体组织和循环系统中的沉积,可以靶向许多器官的自身抗体。
1980年代使用BP血清对人表皮提取物进行的蛋白质印迹分析发现,存在两种BP自身抗原:230-kDa 蛋白(BP230或BP 抗原1 (BPAG1))和180-kDa蛋白(BP180或BP抗原2(BPAG2))。[7,8] 在20世纪90年代初期,分子克隆技术确定了BP230和BP180[9,10] 的氨基酸序列。因为在 BP180中检测到了几个由重复的三联体甘氨酸-X-Y (Gly-X-Y)组成的胶原结构域, BP180 被重新标记为XVII型胶原蛋白 (COL17)。从那时起,一系列研究揭示了这种蛋白质的结构。COL17A1是一种II型跨膜蛋白和半桥粒 (HD)的结构成分,其N端位于细胞质内,C端位于细胞外间隙。它有一个球状细胞内结构域 (ICD) 和一个大的细胞外结构域 (ECD),其中包含散布着非胶原结构域的胶原结构域。 COL17,而不是BP230,被认为是致病性BP自身抗原。因为免疫 EM 显示COL17位于质膜上,而BP230位于表皮角质形成细胞的细胞质中。[11] 此外,COL17A1基因编码胶原蛋白COL17的α链。该基因的突变与良性全身性萎缩性表皮松解症(GABEB)和交界性大疱性表皮松解症(JEB)有关。
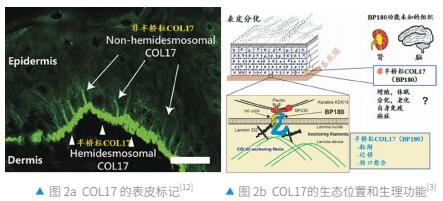
BP和JEB 的起泡表型突出了COL17作为表皮和真皮之间的锚点。然而,人类和小鼠表皮中的COL17标记不仅存在于DEJ 基底膜中,还存在于表皮基底角质形成细胞的顶端外侧质膜中[12](图 2a)。 这一发现导致了半桥粒COL17A1和非半桥粒COL17的分类。非半桥粒COL17可能在角质形成细胞生理学中发挥其它作用。
越来越多的证据表明,干细胞生态位内的细胞-细胞和细胞-细胞外基质粘附对于生态位结构的建立和维持,短距离调节信号的产生和传输以及控制信号的频率,控制干细胞的自我更新和分化至关重要[13]。皮肤老化的原因是新陈代谢能力的衰退,和成体干细胞的自我更新及功能分化有关。皮肤干细胞生态位被认为是皮肤的“青春之泉”。缺乏胶原蛋白COL17A1的小鼠[14] 和具有 COL17A1基因突变的JEB 患者[15] 表现出脱发和头发变白的事实,引起了干细胞老化研究者对 COL17在皮肤老化过程中作用的关注。
XVII型胶原蛋白、黑素细胞干细胞丢失与头发变白
黑色素母细胞是黑素细胞的前体,起源于神经嵴, 部分迁移到毛囊, 在毛囊内进一步分化成合成色素的黑素细胞。长期以来,人们怀疑头发中存在着一个未分化黑素细胞干细胞(melanocyte stem cells,MSCs)池,它也可以补充分化黑素细胞。2002年日本学者西村荣美(Nishimura Emi)等人使用黑素细胞标记技术,识别和定位了存在于毛囊外根鞘的未分化黑素细胞干细胞池。[16] 随着黑素细胞干细胞的发现,也就产生了这样一个问题:头发变白的过程是由于分化的、着色的子代黑素细胞的缺陷、还是由提供它们的未染色的前体细胞黑素干细胞的缺陷而引起的呢?前者关注于生长期中黑素细胞生成黑色素,如酪氨酸酶活性降低、黑色素体转移缺陷和毛囊黑素细胞凋亡等;后者关注黑素干细胞的老化缺陷和生态环境。西村等人首先使用黑色素细胞标记的转基因小鼠和老化的人类毛囊,证明了头发变白是由黑色素细胞干细胞的自我维护缺陷而引起的。[17] Bcl2缺乏会显着加速这一过程,导致黑素细胞干细胞选择性凋亡,但不会导致分化的黑素细胞进入休眠状态。[18]
此外,黑素细胞干细胞的生理老化与生态位内的异位色素沉着或分化有关,黑素细胞主转录调节因子Mitf的突变加速了这一过程。在大多数干细胞系统中,干细胞生态位的组织和维持干细胞所需的锚定基质在很大程度上是未知的。除了存在于滤泡间表皮 (IFE) 的DEJ中,西村等人[19,20] 发现跨膜胶原蛋白COL17A1在位于毛囊凸起区域的毛囊干细胞(hair follicle stem cells,HFSCs)中有较高表达。而黑素细胞干细胞并不表达COL17A,而是直接粘附在HFSCs上。缺乏胶原蛋白COL17的小鼠毛发发育正常,但进入第2个毛发生长初期出现异常,最终导致脱发和头发变白。对基因COL17A1缺失小鼠的分析表明,胶原蛋白COL17A1 通过维持 HFSC 的静止和不成熟对 HFSC 的自我更新至关重要。此外,在COL17A1基因缺失小鼠的基底角质形成细胞(包括HFSCs)中强制表达胶原蛋白COL17A1可以挽救MSCs,免于过早分化并恢复TGF-β信号传导,表明 HFSCs对MSC生态位发挥着关键调节作用。这可能解释了人类胶原蛋白COL17A1缺陷导致脱发白发的潜在机制。即头发变白是由于黑素细胞干细胞自我维持能力的缺陷而造成的,虽然与COL17A1的缺失没有直接关系,但黑素细胞干细胞的流失是同一生态位不同干细胞的竞争合作的结果。表皮干细胞ESC和HFSC中COL17的下调激活该生态位的TGF-β 信号,进而导致了 MSC 的老化。

目前还没有公认的人类头发变白的机理模型。自由基白发理论是一个比较流行的白发机理,强调由环境或内源性因素引起的氧化应激导致毛囊中的黑素细胞凋亡(细胞死亡),从而导致色素的流失。 这一理论得到了一些证据的支持。这些证据表明白发中的过氧化氢水平和DNA损伤增加了。然而,这个理论并不能解释为什么有些毛发的尖端是灰色的,而根部却不是。干细胞白发理论表明毛囊干细胞 (HFSC) 随着年龄的增长而减少,生态位的缺陷导致黑色素细胞干细胞流失,进而引起脱发白发。然而,这一理论却并不能解释为什么有些头发会以不同的速度或模式变白,这可能是受到遗传或激素等其他因素的影响。胶原蛋白 COL17A1的流失只是导致MSC池内干细胞被耗尽的原因之一。过激的压力应激反应也会导致MSC池内干细胞被耗尽,且这种白发化是不可逆转。美国哈佛大学的Ya-Chieh Hsu博士等的研究结果解释了压力是如何导致黑发变白发。[21]
来自交感神经的去甲肾上腺素会被附近的色素再生干细胞吸收,导致色素再生干细胞激活。但在压力过度情况下,压力应激会反应过激,导致去甲肾上腺素分泌过量。使得黑素细胞干细胞全部被激活转化为色素生成细胞,过早地耗尽了贮存库,从而导致干细胞永久性耗竭,不能再生色素而导致白发的出现,且其损害是永久性的。该发现一方面有助于理解现代青年非先天遗传性早白增多现象,解释民间有关“一夜间黑发变白发”的传说。另一方有助于理解头皮按摩这一头皮养护方法,除了促进血液循环,也可适度地刺激立毛肌,促进交感神经分泌去甲肾上腺素,从而激活黑色素干细胞。随着毛囊老化研究的深入,相信白发的延迟和逆转未来可期。
XVII型胶原蛋白、毛囊干细胞和头发稀疏/衰老脱发的关系
脱发是各种内因和外因共同作用导致的结果,其中衰老是不可抗因素。头发稀疏和脱落是显著的衰老表现。对衰老性脱发的机制理解也随着对毛囊干细胞(HFSC)的深入研究而逐渐变得清晰。虽然胎儿产后头皮没有新增毛囊,新头发和旧头发是从同一个地方长出来的。但为了维持表皮和皮脂腺的发育及毛发再生,在发育过程中预留了多能干细胞库。这些珍贵的细胞存在于毛囊外根鞘上的“隆起” 部。[22,23] 毛囊干细胞在休止期到生长期的转变中被激活,开始新一轮的毛发生长。西村等人将小鼠毛囊的衰老过程作为器官衰老研究模型,通过追踪为毛发再生提供重要细胞的毛囊干细胞的命运发现:随着毛囊干细胞的老化,DNA损伤反应延长,可激活ELANE(嗜中性粒细胞弹性蛋白酶),导致维持HFSCs的关键分子胶原蛋白COL17A1的水解流失,从而触发HFSC的衰老。其特征是干细胞特性的丢失和干细胞的分化竞合失调,无法继续正常复制。毛囊干细胞 (HFSC) 在衰老过程中失去了再生能力,是因为采用了非典型的细胞分裂程序。
细胞命运追踪和细胞分裂轴分析表明:虽然年轻小鼠的HFSCs经历典型的对称和不对称细胞分裂以再生毛囊,但在衰老或压力下,它们采用非典型的“压力反应”类型的不对称细胞分裂。这种类型的分裂伴随着半桥粒蛋白COL17A1和细胞极性蛋白aPKCλ的不稳定,并产生终末分化的表皮细胞,而不是再生毛囊生态位。老化的HFSCs通过表皮终末分化为表皮角质形成细胞,周期性地从皮肤中清除。随着这些非典型分裂的重复,HFSCs从基底膜分离,毛囊干细胞生态位逐渐缩小,毛囊本身变小(小型化),最终导致头发稀疏和脱落。[19,26] 研究显示,强制性维持COL17A1的表达可以抑制毛囊干细胞衰老,从而延缓了过度的脱发。这表明胶原蛋白COL17A1的稳态和位于同一生态位,真皮-表皮基底膜区的干细胞竞争性分裂分化有关,毛囊组织中存在以HFSC干细胞为中心的衰老程序,是由干细胞分裂类型从再生型转变为衰老型引起的(图4)。虽然是基于小鼠实验获得的认识,但也在人类自身得到了验证。
所以通过调控胶原蛋白COL17A1的表达,减少胶原蛋白COL17A1的流失可能是预防早白脱发的有效方法之一。尽管导致脱发的原因非常复杂,构成毛囊干细胞微生态的要素也不只是胶原蛋白COL17A1,如CXCL12通过CXCR4/STAT信号通路抑制毛发生长等。[24,25] 但旨在通过控制COL17A1来预防和治疗脱发的应用研究仍有充分的实践价值。DNA的损伤是细胞内外抗氧化机制或促/抗凋亡因子失调随着年龄增长而累积的。避免导致细胞损伤氧化应激,稳定胶原蛋白COL17A1的表达和调节修复损伤的细胞自噬是当前头皮抗老化研究的重点之一。
XVII型胶原蛋白、表皮干细胞与皮肤“年轻态”的关系
随着年龄的增长,皮肤显示出深刻的结构和功能变化,包括表皮和真皮变薄、真皮弹性丧失和皱纹。皮肤老化的原因是新陈代谢能力的衰退,和成体干细胞的自我更新和功能分化有关。干细胞生态位被认为是皮肤“年轻态的青春之泉”[27-29]。
干细胞是组织稳态的基础,对底层细胞外基质的粘附被认为是表皮干细胞维持稳态的一个重要因素 [30, 31]。胶原蛋白 (COL17) 就是一种在基底表皮中表达的跨膜蛋白。COL17是aPKC-PAR复合物的结合伙伴,它是细胞极性的关键调节因子。 免疫沉淀-免疫印迹测定和蛋白质-蛋白质结合测定表明COL17与aPKC和PAR3 相互作用。COL17缺陷或表皮特异性aPKCλ缺失使表皮中的PAR3分布不稳定,而aPKCζ 敲除则没有。在COL17-null新生儿表皮中出现不对称细胞分裂。这些结果表明COL17是维持表皮细胞极性的关键。
通过对小鼠表皮干细胞老化研究发现,表皮干细胞的半桥粒组分XVII型胶原蛋白(COL17A1)的表达通过基因组/氧化应激诱导的蛋白水解在生理上波动,并且由此产生的COL17A1在个体干细胞中的差异表达驱动的干细胞间竞争(stem cell competition)。小鼠体内克隆分析和体外3D建模表明,表达高水平COL17A1的克隆(对称分裂)在竞争中胜出并消除相邻的表达低水平COL17A1(不对称分裂)的应激克隆。具有更高潜力或质量的干细胞因此被选择用于维持内稳态。由此保持表皮角化细胞的年轻(质),抑制老化(图4)。但是随着年龄的增长,它们最终会因失去COL17A1而限制它们的竞争,从而导致衰老。由此产生的半桥粒脆性和干细胞分层会耗尽相邻的黑素细胞和成纤维细胞,从而促进皮肤老化。相反,强制维持COL17A1可以挽救皮肤器官的老化,从而表明COL17A1是抗衰老治疗干预的潜在靶标。[32]

皮肤再生能力随着年龄的增长而下降,但其潜在机制在很大程度上是未知的。 最近的研究揭开表皮生长因子受体(EGFR)信号和XVII型胶原蛋白(COL17A1)蛋白水解在皮肤再生中与年龄相关的角质形成细胞干细胞动力学改变之间的功能联系。实时成像和计算机模拟实验预测,人类角质形成细胞干细胞的运动与自我更新和表皮再生有关。受体酪氨酸激酶阵列确定了小鼠皮肤伤口愈合中EGFR信号的年龄相关衰退。培养实验证明,EGFR 激活通过分泌金属蛋白酶组织抑制剂 1 (TIMP1) 抑制其蛋白水解,从而随着COL17A1的增加驱动人角质形成细胞干细胞运动。有趣的是,COL17A1 通过协调肌动蛋白和角蛋白丝网络直接调节角质形成细胞干细胞运动和集体细胞迁移。结论是EGFR-COL17A1轴介导的角质形成细胞干细胞运动驱动表皮再生,这为与年龄相关的受损皮肤再生提供了一种新的治疗方法。[33]
今后的课题与展望
综上所述,干细胞老化研究表明干细胞生态位稳定的重要性。同一皮肤生态位干细胞竞合决定了皮肤的遗传表观和活力。作为干细胞生态位构成成分胶原蛋白 COL17 是皮肤衰老的关键调节剂(图5)。

然而,胶原蛋白COL17只是干细胞生态位构成成分之一而不是全部。科学家们才刚刚开始阐明将COL17 与各种生理过程(如各种细胞和组织的分化、迁移和衰老)的调节联系起来的信号通路。而且关于调节COL17水平的详细上下游机制,仍然存在许多悬而未决的问题。例如,COL17如何影响表皮中的信号通路?包括TGF-β、Wnt、Rac1和p38MAPK?什么调节半桥粒COL17及非半桥粒COL17的差异表达?二者的功能是重叠还是独立?非半桥粒BP180在基底角质形成细胞中的功能仍知之甚少,对其在大脑、肾脏和胎盘中的作用几乎一无所知。COL17在细胞迁移调控中的矛盾作用尚未得到证实,何时切断(水解?) 、如何切断?COL17细胞内运输是否与其它胶原蛋白相似?皮肤癌与COL17有无关系?COL17表达的动态变化和干细胞旁分泌及归巢机制(定向细胞迁移的调节)的关系?等等……

此外,由于COL17表达的动态变化以及分化状态的细胞在创伤皮肤的谱系追踪中返回到COL17A1high状态,探索COL17在干细胞可塑性中的功能将是未来的重要挑战。值得注意的是胶原蛋白COL17是跨膜蛋白,通过体外添加所谓人工组合胶原蛋白COL17是不可能被细胞所吸收利用的。目前主要应用研究着眼于促进胶原蛋白COL17稳定表达和抑制COL17水解[35-37]。后者是基于蛋白酶和蛋白酶抑制剂在COL17A1蛋白水解中的作用研究,包括蛋白酶MMP9、ADAM9、10、17和ELANE [38-41],以及蛋白酶抑制剂PAI-1、PAI-2、A1AT、TIMP1 、TIMP2和TIMP3 [42]。只有充分研究COL17的功能和机制并进行相应的临床试验后,才有可能提出未来延缓皮肤老化的化妆品开发策略。
结论
以西村教授为首的研究人员的基础研究成果,使得毛囊干细胞中的XVII型胶原蛋白(COL17)与脱发和白发之间的关系越来越清晰。虽还需不断深入研究,但据已发布的成果可以判断:通过调控胶原蛋白COL17A1的表达,减少胶原蛋白COL17的流失可能是预防白发与脱发的有效方法之一。但这并不意味着将XVII胶原蛋白直接涂抹于皮肤或通过口服摄取就会起到防止脱发或白发的作用。
作者:甘智斌[1]、杨建中[1,2],
[1] 美研创新株式会社、[2] 株式会社O and R
参考文献:
1. Liu, B., Qu, J., Zhang, W., Izpisua Belmonte, J. C., & Liu, G. H. (2022). A stem cell aging framework, from mechanisms to interventions. Cell reports, 41(3), 111451. https://doi.org/10.1016/j.celrep.2022.111451
2. Drummond-Barbosa D. (2008). Stem cells, their niches and the systemic environment: an aging network. Genetics, 180(4), 1787–1797. https://doi.org/10.1534/genetics.108.098244
3. Tuusa, J., Kokkonen, N., & Tasanen, K. (2021). BP180/Collagen XVII: A Molecular View. International journal of molecular sciences, 22(22), 12233. https://doi.org/10.3390/ijms222212233
4. Natsuga, K., Watanabe, M., Nishie, W., & Shimizu, H. (2019). Life before and beyond blistering: The role of collagen XVII in epidermal physiology. Experimental dermatology, 28(10), 1135–1141. https://doi.org/10.1111/exd.13550
5. Owczarzy, A., Kurasiński, R., Kulig, K., Rogóż, W., Szkudlarek, A., Maciążek-Jurczyk, M. (2020). Collagen - structure, properties and application. Engineering of Biomaterials, (156), 17-23. https://doi.org/10.34821/eng.biomat.156.2020.17-23
6. 20230220-商贸零售行业深度报告:胶原蛋白:重组胶原有望助力供给突破,颜值经济“胶”响曲即将迎来华彩篇章-开源证券
7. Labib, R. S., Anhalt, G. J., Patel, H. P., Mutasim, D. F., & Diaz, L. A. (1986). Molecular heterogeneity of the bullous pemphigoid antigens as detected by immunoblotting. Journal of immunology (Baltimore, Md. : 1950), 136(4), 1231–1235.
8. Stanley, J. R., Woodley, D. T., & Katz, S. I. (1984). Identification and partial characterization of pemphigoid antigen extracted from normal human skin. The Journal of investigative dermatology, 82(1), 108–111. https://doi.org/10.1111/1523-1747.ep12259224
9. Sawamura, D., Li, K., Chu, M. L., & Uitto, J. (1991). Human bullous pemphigoid antigen (BPAG1). Amino acid sequences deduced from cloned cDNAs predict biologically important peptide segments and protein domains. The Journal of biological chemistry, 266(27), 17784–17790.
10. Giudice, G. J., Emery, D. J., & Diaz, L. A. (1992). Cloning and primary structural analysis of the bullous pemphigoid autoantigen BP180. The Journal of investigative dermatology, 99(3), 243–250. https://doi.org/10.1111/1523-1747.ep12616580
11. Ishiko, A., Shimizu, H., Kikuchi, A., Ebihara, T., Hashimoto, T., & Nishikawa, T. (1993). Human autoantibodies against the 230-kD bullous pemphigoid antigen (BPAG1) bind only to the intracellular domain of the hemidesmosome, whereas those against the 180-kD bullous pemphigoid antigen (BPAG2) bind along the plasma membrane of the hemidesmosome in normal human and swine skin. The Journal of clinical investigation, 91(4), 1608–1615. https://doi.org/10.1172/JCI116368
12. Watanabe, M., Natsuga, K., Nishie, W., Kobayashi, Y., Donati, G., Suzuki, S., Fujimura, Y., Tsukiyama, T., Ujiie, H., Shinkuma, S., Nakamura, H., Murakami, M., Ozaki, M., Nagayama, M., Watt, F. M., & Shimizu, H. (2017). Type XVII collagen coordinates proliferation in the interfollicular epidermis. eLife, 6, e26635. https://doi.org/10.7554/eLife.26635
13. Raymond, K., Deugnier, M. A., Faraldo, M. M., & Glukhova, M. A. (2009). Adhesion within the stem cell niches. Current opinion in cell biology, 21(5), 623–629. https://doi.org/10.1016/j.ceb.2009.05.004
14. Nishie, W., Sawamura, D., Goto, M., Ito, K., Shibaki, A., McMillan, J. R., Sakai, K., Nakamura, H., Olasz, E., Yancey, K. B., Akiyama, M., & Shimizu, H. (2007). Humanization of autoantigen. Nature medicine, 13(3), 378–383. https://doi.org/10.1038/nm1496
15. Yancey, K. B., & Hintner, H. (2010). Non-herlitz junctional epidermolysis bullosa. Dermatologic clinics, 28(1), 67–77. https://doi.org/10.1016/j.det.2009.10.008
16. Nishimura, E. K., Jordan, S. A., Oshima, H., Yoshida, H., Osawa, M., Moriyama, M., Jackson, I. J., Barrandon, Y., Miyachi, Y., & Nishikawa, S. (2002). Dominant role of the niche in melanocyte stem-cell fate determination. Nature, 416(6883), 854–860. https://doi.org/10.1038/416854a
17. Nishimura, E. K., Suzuki, M., Igras, V., Du, J., Lonning, S., Miyachi, Y., Roes, J., Beermann, F., & Fisher, D. E. (2010). Key roles for transforming growth factor beta in melanocyte stem cell maintenance. Cell stem cell, 6(2), 130–140. https://doi.org/10.1016/j.stem.2009.12.010
18. Tanimura, S., Tadokoro, Y., Inomata, K., Binh, N. T., Nishie, W., Yamazaki, S., Nakauchi, H., Tanaka, Y., McMillan, J. R., Sawamura, D., Yancey, K., Shimizu, H., & Nishimura, E. K. (2011). Hair follicle stem cells provide a functional niche for melanocyte stem cells. Cell stem cell, 8(2), 177–187. https://doi.org/10.1016/j.stem.2010.11.029
19. Matsumura, H., Mohri, Y., Binh, N. T., Morinaga, H., Fukuda, M., Ito, M., Kurata, S., Hoeijmakers, J., & Nishimura, E. K. (2016). Hair follicle aging is driven by transepidermal elimination of stem cells via COL17A1 proteolysis. Science (New York, N.Y.), 351(6273), aad4395. https://doi.org/10.1126/science.aad4395
20. Zhang, B., Ma, S., Rachmin, I., He, M., Baral, P., Choi, S., Gonçalves, W. A., Shwartz, Y., Fast, E. M., Su, Y., Zon, L. I., Regev, A., Buenrostro, J. D., Cunha, T. M., Chiu, I. M., Fisher, D. E., & Hsu, Y. C. (2020). Hyperactivation of sympathetic nerves drives depletion of melanocyte stem cells. Nature, 577(7792), 676–681. https://doi.org/10.1038/s41586-020-1935-3
21. Clark, S. A., & Deppmann, C. D. (2020). How the stress of fight or flight turns hair white. Nature, 577(7792), 623–624. https://doi.org/10.1038/d41586-019-03949-8
22. Taylor, G., Lehrer, M. S., Jensen, P. J., Sun, T. T., & Lavker, R. M. (2000). Involvement of follicular stem cells in forming not only the follicle but also the epidermis. Cell, 102(4), 451–461. https://doi.org/10.1016/s0092-8674(00)00050-7
23. Oshima, H., Rochat, A., Kedzia, C., Kobayashi, K., & Barrandon, Y. (2001). Morphogenesis and renewal of hair follicles from adult multipotent stem cells. Cell, 104(2), 233–245. https://doi.org/10.1016/s0092-8674(01)00208-2
24. Zheng, M., Oh, S. H., Choi, N., Choi, Y. J., Kim, J., & Sung, J. H. (2022). CXCL12 inhibits hair growth through CXCR4. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 150, 112996. https://doi.org/10.1016/j.biopha.2022.112996
25. Yamada, T., Hasegawa, S., Hasebe, Y., Kawagishi-Hotta, M., Arima, M., Iwata, Y., Kobayashi, T., Numata, S., Yamamoto, N., Nakata, S., Sugiura, K., & Akamatsu, H. (2019). CXCL12 regulates differentiation of human immature melanocyte precursors as well as their migration. Archives of dermatological research, 311(1), 55–62. https://doi.org/10.1007/s00403-018-1880-2
26. Matsumura, H., Liu, N., Nanba, D. et al. Distinct types of stem cell divisions determine organ regeneration and aging in hair follicles. Nat Aging 1, 190–204 (2021). https://doi.org/10.1038/s43587-021-00033-7
27. Hsu, Y. C., Li, L., & Fuchs, E. (2014). Emerging interactions between skin stem cells and their niches. Nature medicine, 20(8), 847–856. https://doi.org/10.1038/nm.3643
28. Li, L., & Xie, T. (2005). Stem cell niche: structure and function. Annual review of cell and developmental biology, 21, 605–631. https://doi.org/10.1146/annurev.cellbio.21.012704.131525
29. Morrison, S. J., & Spradling, A. C. (2008). Stem cells and niches: mechanisms that promote stem cell maintenance throughout life. Cell, 132(4), 598–611. https://doi.org/10.1016/j.cell.2008.01.038
30. Watt F. M. (2002). Role of integrins in regulating epidermal adhesion, growth and differentiation. The EMBO journal, 21(15), 3919–3926. https://doi.org/10.1093/emboj/cdf399
31. Green H. (1977). Terminal differentiation of cultured human epidermal cells. Cell, 11(2), 405–416. https://doi.org/10.1016/0092-8674(77)90058-7
32. Liu, N., Matsumura, H., Kato, T., Ichinose, S., Takada, A., Namiki, T., Asakawa, K., Morinaga, H., Mohri, Y., De Arcangelis, A., Geroges-Labouesse, E., Nanba, D., & Nishimura, E. K. (2019). Stem cell competition orchestrates skin homeostasis and ageing. Nature, 568(7752), 344–350. https://doi.org/10.1038/s41586-019-1085-7
33. Nanba, D., Toki, F., Asakawa, K., Matsumura, H., Shiraishi, K., Sayama, K., Matsuzaki, K., Toki, H., & Nishimura, E. K. (2021). EGFR-mediated epidermal stem cell motility drives skin regeneration through COL17A1 proteolysis. The Journal of cell biology, 220(11), e202012073. https://doi.org/10.1083/jcb.202012073
34. Liu, Y., Ho, C., Wen, D., Sun, J., Huang, L., Gao, Y., Li, Q., & Zhang, Y. (2022). Targeting the stem cell niche: role of collagen XVII in skin aging and wound repair. Theranostics, 12(15), 6446–6454. https://doi.org/10.7150/thno.78016
35. CN 111568960 A 白发抑制改善剂及其制造方法
36. CN 113874044 A 皮肤组合物
37. Honda Igarashi, M., da Silva, S. G., Mercuri, M., Zuardi, F. M. O. N., Facchini, G., da Silva, G. H., Lucia Tabarini Alves Pinheiro, A., & Eberlin, S. (2021). Novel complex of cosmetic ingredients with promising action in preventing hair loss and follicular aging through mechanism involving enrichment of WNT/signaling, mitochondrial activity, and stem cells maintenance. Journal of cosmetic dermatology, 20(7), 2179–2189. https://doi.org/10.1111/jocd.13815
38. Franzke, C. W., Tasanen, K., Schäcke, H., Zhou, Z., Tryggvason, K., Mauch, C., Zigrino, P., Sunnarborg, S., Lee, D. C., Fahrenholz, F., & Bruckner-Tuderman, L. (2002). Transmembrane collagen XVII, an epithelial adhesion protein, is shed from the cell surface by ADAMs. The EMBO journal, 21(19), 5026–5035. https://doi.org/10.1093/emboj/cdf532
39. Franzke, C. W., Bruckner-Tuderman, L., & Blobel, C. P. (2009). Shedding of collagen XVII/BP180 in skin depends on both ADAM10 and ADAM9. The Journal of biological chemistry, 284(35), 23386–23396. https://doi.org/10.1074/jbc.M109.034090
40. Hofmann, S. C., Voith, U., Schönau, V., Sorokin, L., Bruckner-Tuderman, L., & Franzke, C. W. (2009). Plasmin plays a role in the in vitro generation of the linear IgA dermatosis antigen LADB97. The Journal of investigative dermatology, 129(7), 1730–1739. https://doi.org/10.1038/jid.2008.424
41. Laval, S., Laklai, H., Fanjul, M., Pucelle, M., Laurell, H., Billon-Galés, A., Le Guellec, S., Delisle, M. B., Sonnenberg, A., Susini, C., Pyronnet, S., & Bousquet, C. (2014). Dual roles of hemidesmosomal proteins in the pancreatic epithelium: the phosphoinositide 3-kinase decides. Oncogene, 33(15), 1934–1944. https://doi.org/10.1038/onc.2013.146
42. Lin, L., Betsuyaku, T., Heimbach, L., Li, N., Rubenstein, D., Shapiro, S. D., An, L., Giudice, G. J., Diaz, L. A., Senior, R. M., & Liu, Z. (2012). Neutrophil elastase cleaves the murine hemidesmosomal protein BP180/type XVII collagen and generates degradation products that modulate experimental bullous pemphigoid. Matrix biology : journal of the International Society for Matrix Biology, 31(1), 38–44. https://doi.org/10.1016/j.matbio.2011.09.003
来源:荣格-《国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。