荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
摘要
目的: 本研究旨在研究基于糖的结构,即 XAX(木糖醇基葡糖苷-脱羟基木糖醇-木糖醇)在体外和体内对皮肤屏障功能和保湿的影响,并将其功效与甘油进行比较。
方法: 通过RT - qPCR分析对局部处理的人类重建表皮进行基因表达研究。在局部处理的人皮肤外植体中通过色谱法测量神经酰胺新合成。在原代细胞培养物中监测必需蛋白质的产生:使用色谱法测定成纤维细胞中监测硫酸软骨素和透明质酸;使用ELISA角质形成细胞中的透明质酸。对25名皮肤干燥的女性志愿者测量了表皮微起伏、皮肤电容和经表皮水分流失(TEWL)。还测量了手上的皮肤电容和TEWL,并比较了水醇凝胶。
结果: XAX增加了关键保湿相关基因的表达,例如角质形成细胞间连接、角化层、脱屑过程以及皮肤屏障功能和水合作用的酶、结构成分或调节因子。它还增加了神经酰胺、透明质酸和硫酸软骨素的含量。3%的XA X处理降低了TEWL并增加了皮肤电容、皮肤微观纹理和脱屑。与单独使用甘油相比,XAX+甘油(1.5%+1.5%)的组合显示出有趣的效果。
结论: XA X对涉及皮肤屏障功能的生物学通路即表皮和真皮水储备、表皮水循环有促进作用。证实,无论是单独使用还是与甘油结合使用,使其成为基本润肤剂、润湿剂和封闭剂的有趣替代品。
引言
皮肤是覆盖全身的复杂器官。它的一些主要功能是保护身体免受环境的侵害,并有助于其体内平衡。皮肤保湿是健康皮肤外观的关键(Draelos, 2018)。例如,干燥的特征是粗糙,表面呈纸莎草状,存在凸起的鳞片和/或鳞屑以及刺激(Haftek , 2015)。表皮是皮肤最表层的组织,对皮肤的屏障功能起着很大的作用。
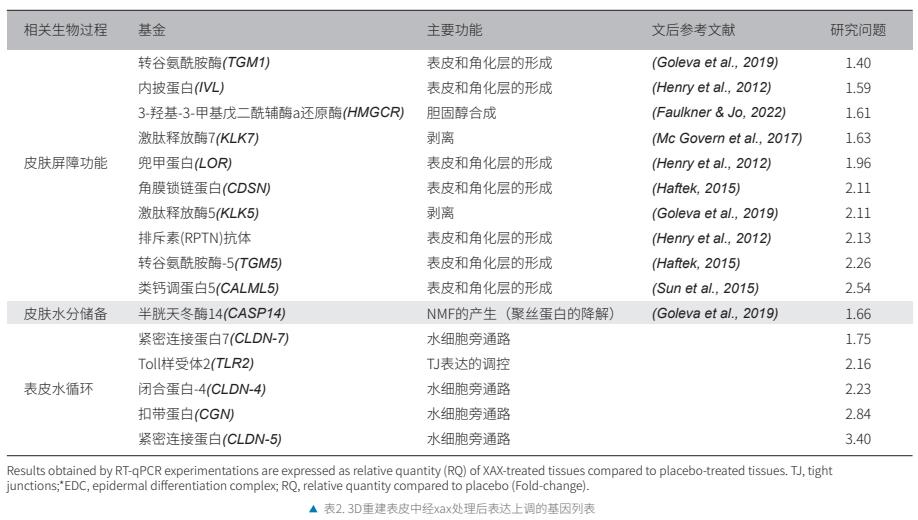
这种不断自我更新的多层组织主要由角质形成细胞组成(85-95%)。角质形成细胞经过严格调控的分化程序,依次形成皮肤的基底层(SB)、有棘层(SS)、颗粒层(SG)和角质层(SC)(Goleva et al., 2019; Lefèvre-Utile et al., 2021)。正确的角质细胞分化和表皮稳态是确保皮肤水合状态的必要条件。每个表皮层都含有特定分化阶段的角质形成细胞,并通过其特有形态和生化特征的表达来定义,目的是产生一个内聚组织。
例如,基底角质形成细胞具有高增殖能力,是表皮维持和再生的关键。角蛋白(KRT) 5和14的表达是这些细胞的特征。 此外,人类1号染色体上一个2 mb的位点称为表皮分化复合体(EDC),由60个基因编码参与角化细胞分化和SC特性的蛋白质(Henry et al., 2012)。在这些蛋白中,重复蛋白(RPTN)被检测到与颗粒状角质形成细胞以及loricrin兜甲蛋白(LOR)和聚丝蛋白(FLG)密切相关。随着角化细胞的分化,外皮蛋白Involucrin (IVL)和LOR的表达增加。转谷氨酰胺酶(TG),特别是TGM1,交联IVL, LOR和其他结构蛋白,形成凝固的包膜,并提供SC的机械强度(Goleva et al., 2019)。角化前不久,角化细胞合成并分泌角膜粘连蛋白(CDSN),其自发嵌入SG桥粒内 (Haftek, 2015)。钙调素样5(CALML5)也是表皮后期分化所必需的(Sun et al., 2015)。最后,角化层主要由两层LOR组成,整个被多层脂质结构和亲水的角细胞内物质包围,主要是天然保湿因子(NMF)。
SC脂质的主要成分是神经酰胺(45%-50%)、胆固醇(25%)和游离脂肪酸(10%-15%)。神经酰胺是形成经皮水分流失的天然屏障所必需的(Lefevre-Utile et al. , 2021)。最后,为了实现脱屑过程,CDSN必须被蛋白酶和桥粒钙粘蛋白降解。 尤其是KLK5和KLK7,可以切割角膜桥粒的细胞外成分,如CDSN,使细胞连接松动并使剥离(Haftek , 2015; Mc Govern et al., 2017)。
除了适当的角质细胞分化和SC结构外,表皮内的水运输主要由水通道蛋白(AQP)和紧密连接(TJ)调节。TJ存在于颗粒层中,构成细胞间的封闭(Zaniboni et al., 2016)。在这些蛋白质中, 紧密连接蛋白(CLDN), 闭合蛋白, 闭锁小带(ZO), 扣带蛋白(CGN)和多PDZ域蛋白(MUPP-1)都与功能性TJ屏障有关(Crawford & Dagnino, 2017)。
真皮层影响皮肤的生物力学特性,如柔韧性,对皮肤表面的外观以及皮肤的含水量也有积极的影响。 这主要是由于细胞外基质(ECM)成分的存在。 其中,糖胺聚糖(GAG),尤其是透明质酸(HA)作为皮肤的蓄水池,参与皮肤保湿(Sodhi & Panitch, 2021)。例如,透明质酸能够在水中结合其重量的1000倍。相反,GAG含量的降低会引起皮肤干燥。与透明质类似,硫酸软骨素(CS),另一种GAG,当与蛋白聚糖结合时,如聚蛋白多糖,在保持水分方面起关键作用。
分析一种成分对这些典型基因和蛋白质表达的影响,对了解其作用机制具有重要意义。皮肤水合作用对保持皮肤健康至关重要,这解释了为什么润肤霜是基础皮肤护理的重要组成部分。事实上,这是世界上大多数地区所有年龄层的人的普遍需要。
在此背景下,本研究旨在研究一种特定的糖基结构(液体和水溶性)在体外和体内的作用。例如XAX (INCI: 木糖醇基葡糖苷-脱水木糖醇-木糖醇), 对皮肤的屏障功能和保湿。在大多数体外模型和特定的临床试验中,通过测量水-酒精凝胶对皮肤脱水的预防作用,比较XAX与甘油的功效。
方法
1. 保湿相关基因在人体重建表皮三维模型中的表达
重建表皮(EPI/001; StratiCELL®, Belgique)在专有的无血清培养基中置于气液界面,并在37℃ 和5% CO2的潮湿气氛中保持。14天后表皮完全分化时,局部应用安慰剂水包油乳液(不含XAX)或含有3% XAX的相同配方(表1),浓度为2mg /cm2。实验是在重复培养中实现的。孵育24小时后,按照供应商的建议,使用总RNA小提试剂盒(Qiagen,美国)提取表皮组织的总核糖核酸(RNA),并将其反转录成互补DNA (cDNA)。使用专用微流体技术的384孔TaqMan阵列(Applied Biosystems, USA),对92个与表皮分化和皮肤屏障功能相关的基因进行qPCR分析。计算周期阈值(Ct), 并使用Applied Biosystems的Data Assist软件进行基因表达分析。 将清洁基因(hk)的Ct值归一化,并通过以下计算获得相对数量(RQ):2-(△Ct治疗组-△Ct安慰剂治疗组参照组),其中△Ct=每个cDNA样本的Ct靶基因- Ct hk。仅考虑RQ值大于1.4且标准差小于30%的基因。使用genesspring®软件(Agilent)进行显著通路分析。
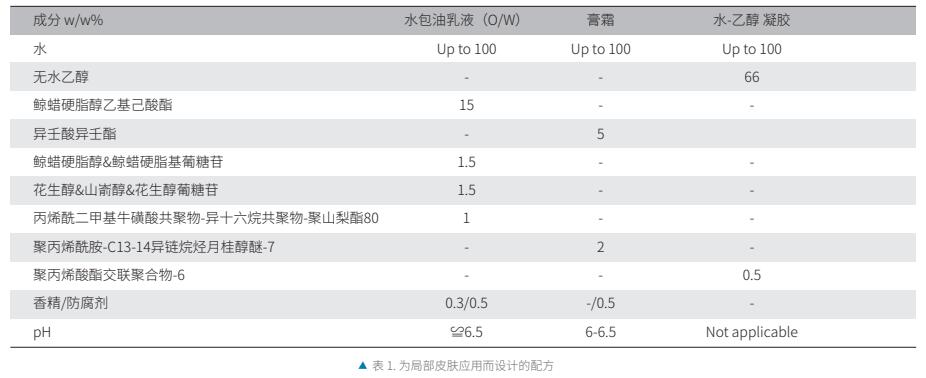
2. 人体正常皮肤外植体神经酰胺合成的测定
本文从一位35岁妇女的腹部整形术中制备了人体皮肤外植体。直径为8mm的皮盘在MEM/M199(3:1, Gibco)培养基中培养,并添加50 IU/mL青霉素、50μg/mL链霉素、0.2% (w/v) 碳酸氢钠、2% 胎牛血清(FCS; SeraTech Zellbiologische produckte, Skt Salvator,德国)和1μCi/mL碳14标记的醋酸酯(Gibco)。
将安慰剂霜凝胶或含3%甘油或3% XAX的相同配方(表1)以2mg /cm2的浓度涂于皮肤外植体表面。以表皮生长因子(EGF)10 ng/mL为参比分子,在皮肤外植体培养基中进行检测。对照皮肤外植体也在没有产品的情况下孵育。皮肤外植体在 37℃下孵育:- 5% CO2孵育18小时(3次)。孵育结束时,通过可控热冲击(MilliQ水,2分钟,62℃)将表皮与真皮层分离,并用胰酶1% (ICN Biomedicals Inc.,USA)在37℃下消化过夜。
新合成的脂质用碳14标记,在有机相(甲醇/氯仿(1:2))和水相(0.25 M氯化钾)之间进行分离。然后有机相在氮气下蒸发,残留物被吸收在(2:1)氯仿/甲醇混合物中。然后将样品(20μL,对应3700计数/分钟,cpm)涂于silica60色谱板(Merck, Allemagne)上,在三种连续溶剂中洗脱:氯仿/丙酮/甲醇(38:2:10);氯仿/丙酮/甲醇(40:5:5);氯仿/乙酸乙酯/醚/甲醇,(36:10:3:1)。 用适当的标准将神经酰胺1和2的位置与其他表皮脂质区分开来。使用放射性分析仪(Storm,UK)对分离点的放射性进行计数。结果以表皮的cpm/mg为单位表达。计算各治疗组的均值和标准差。治疗组与对照组比较采用Student's t检验(p<0.05)。
3. 正常人体角质形成细胞中透明质酸含量的测定
正常人表皮角质形成细胞(NHEK),来自37岁女性供体(Lonza, b<e:1>,瑞士)在角质细胞生长培养基(KGM)Gold(Lonza)中的48孔板中培养,在5% CO2的37℃潮湿环境中培养5天。然后,NHEK用0.01%或0.1% XAX或参比分子,即0.2μM维甲酸(Sigma- Aldrich)(四次处理)处理(或不处理)。 孵育24 h后,每孔取上清液150μL测定HA。在孵育结束(48 h)时,用RIPA缓冲液分析细胞以定量总蛋白。
采用特异性酶联免疫吸附试验(ELISA)试剂盒(Hyaluronan DuoSet kit, R&D Systems, Minneapolis, USA)测定上清液中HA的含量。用二喹啉甲酸测定法 (Interchim, France)测定细胞裂解物中的总蛋白含量。计算各组归一化HA数量(ng HA/ μg总蛋白)的平均值和标准差,以及与对照组(未经处理的细胞)比较的变化百分比。采用Student's t检验评定统计学显著性,p<0.05为显著。
4. 正常人体真皮成纤维细胞中透明质酸和硫酸软骨素含量的测定
正常人真皮成纤维细胞(NHDF), 来自36 岁女性供体(Biopredic International, France)在MEM/M199(3:1, Gibko)培养基中培养,添加2mMl-谷氨酰胺、50 IU/mL青霉素、50μg/mL链霉素、0.185% (v/ v)碳酸氢钠和10% FCS,在37℃、5% CO2的潮湿环境中培养。13天后,细胞不受XAX(0.001%,0.01%或0.1%),甘油(0.01%或0.1%)或参比分子,即10 ng/mLEGF(三次重复)的处理。孵育4天后,收集上清液测定透明质酸(HA)和硫酸软骨素(CS)的剂量。用美国Sigma-Aldrich公司的stainall染色后,分别在630 nm和450 nm处用分光光度法进行定量。结果以μg/mL HA或CS表达。对于每个治疗组,计算平均值和标准差(SD),以及与对照组(未经处理的细胞)相比的变化百分比。治疗组与对照组比较采用Student's t检验(p<0.05)。
5. 设计人体皮肤水合作用的临床试验,将3% XAX乳液与安慰剂乳液进行比较
医学控制下,对25名女性志愿者(平均年龄:40岁,22~60岁)进行了随机双盲临床研究,受试者腿部皮肤干燥(角膜测量值在45±5% ~ 55±5%任意单位(a.u)之间)。
在研究的第一天(D1),以2mg /cm2的剂量将安慰剂水包油乳液和添加3% XAX的相同配方(表1)应用于一条腿的外侧。
将未应用产品的区域作为 “绝对控制”区域,以遵循第一天测量的可变性:D1T0在任何应用产品之前,d1t8在第一次应用产品后8小时。随后,志愿者们在腿上使用了这些面霜(每条腿一个;随机)每日2次,从D1晚至D29晚。分别于涂抹后15天和30天后进行中期和最终测试。每次,志愿者到达评估中心时都没有涂抹任何面霜(最后一次涂抹必须在大约12小时前)。所有测量均在空调室内(18±1℃,相对湿度55%±5%)进行,并在志愿者适应环境至少30分钟后完成。
1)纹理和脱屑评价
在每次测量(D1T0, D15和D30)时,使用Diagnoskin®从腿部外侧区域采集一个SC样本。在恒压下(约150 g/cm2,持续10s)将可控制黏附性的透明方片施加于测量区域,然后剥离。显微检查评估微结构网络(皮肤微纹理)和脱屑的形态学分析,并通过验证评分(评分从1到12)进行量化。 计算每个测量时间的平均值、SD和SEM,以及安慰剂平均值和XAX平均值之间的变化百分比。
2)皮肤电容测量
在D1T0、D1T8h、D15和D30时测定皮肤水分。每次,使用CM 820TM测角仪(Courage and Khazaka Electronic Gmbh)对每条腿的外部进行三次测量和平均值。SC含水率计算公式为:Z={R2+[(1/(2π fc)]2}½,其中Z:阻抗;R:阻力;f:电流频率,C:容量。得到的值用a.u表示(Jemec & Na,2002)。
3)TEWL测量
在D1T0, D1T8h, D15和D30进行TEWL测量。利用蒸发仪(Tewameter TM 210;Courage and Khazaka electronics Gmbh)。结果以g/m2/h表示。
4) 数据处理
对于每个产品,计算每个测量时间和点的平均值和SEM(测角法和TEWL)。
根据以下公式计算安慰剂与XAX在不同时间的变化百分比:%=(TAtiXAX - TAtiplacebo)/ TAtiplacebo
(TA :处理区域的平均值 / ti: 在产品应用后的不同测量时间)。
对于皮肤电容,使用Student's t检验对每次测量时的值进行组内和组间比较,显著性水平为5%。对于TEWL,使用Student's t检验分别对每次测量值和随时间变化的值进行组内和组间比较。
6. 设计手部皮肤水合作用的临床试验,比较分别含1.5%XAX+1.5%甘油或单独3%甘油的水醇凝胶。
一项临床研究在医学控制下对三组20名不同皮肤类型的女性志愿者进行(年龄从20岁到63岁不等,平均年龄在41岁到48岁之间,视组而定)试验前有48小时的洗脱期。然后,志愿者必须使用安慰剂水醇凝胶和添加3% XAX或添加1.5% XAX+1.5%甘油的相同配方(表1),每天至少5次(平均应用次数:每天8次),并有适当的使用说明。
1)皮肤电容测量
皮肤保湿度的测量使用CM825®(Courage & Khazaka, Electronic GmbH)测角仪。(德国科隆),在任何产品应用前T0和产品使用24小时后。
2)TEWL测量
使用Tewameter300®(Courage and Khazaka, Electronic GmbH)在任何产品应用前T0和产品使用8天进行Tewameter 300®测量。
3)自我评估
在研究结束时,通过自我评估问卷调查志愿者对测试产品的意见。
4)数据处理
对于每个产品,计算每个测量时间和点的平均值、SD和SEM(测角法和TEWL)。 根据每位志愿者的变化百分比的平均值[(TAti-TAt0)/TAt0]×100,计算变异与T0的百分比。根据公式计算与安慰剂的差异百分比::{[(TAti-TAt0)XAX-(TAti-TAt0)placebo]/[TAt0XAX+(TAti-TAt0)placebo]}×100(式中:TA:处理区域得到的平均值/t0:产品应用前/ti:产品应用后不同测量时间)。
自我评估问卷的结果以指定特定判断(在建议的判断中)的受试者的百分比(%)计算。仪器数据进行Student's t-test检验。对原始数据与基线(T0)进行组内统计分析。进行组间统计分析,比较每个实验时间每种活性产品与相应安慰剂产品记录的变化。当p值<0.05时,认为差异有统计学意义。
结果
1. 人体重建表皮中皮肤水合作用相关基因的表达对RT-qPCR调查结果进行的倍数变化和通路分析显示,与安慰剂治疗相比,在3D重建的人表皮上局部应用含xax的配方可诱导编码皮肤屏障功能、皮肤水分储备和表皮水循环相关蛋白的基因上调(表2)。水通道蛋白3的表达也有所增加,但未达到阈值(即1.32;数据未显示)。
2. 神经酰胺在人体皮肤移植模型中的新合成
采用皮肤外植体模型研究XAX对神经酰胺新生的影响。
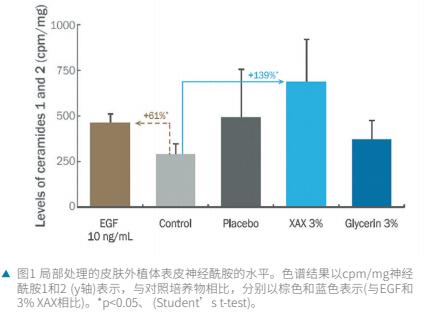
在我们的实验条件下, 在皮肤外植体培养基中以1 0ng/mL的浓度检测EGF,与未处理的外植体相比,表皮神经酰胺1和2的新合成增加了61%(p<0.05;图1).配制成浓度为3%的XAX并应用于皮肤外植体表面,与未处理的外植体相比,表皮神经酰胺1和2的新合成增加了139%(p<0.05;图1)。与未处理的外植体相比,安慰剂配方增加了73%,但没有统计学意义(图1)。与未处理的外植体相比,3%配方的甘油对表皮神经酰胺1和2的新合成没有显著影响(+28%;图1)。
未完待续,更多体外及临床试验结果、结果讨论、参考文献见7月刊

来源:荣格-《国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。