荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
纳米级细胞外囊泡(nanosized extracellular vesicles,nEV)由所有真核细胞释放到细胞外空间中,作为细胞间通讯的重要介质,在各种体液中都能检测到其存在。nEV携带供体细胞的核酸、脂质、蛋白质和代谢产物,并将其转移给邻近远处的受体细胞,从而导致其生物表型发生变化。正是这种特性使nEV成为药物治应用的合适载体。与合成纳米粒子相比,使用nEV作为药物递送系统具有多种优点,包括生物相容性、自然的靶向能力和长期安全性。此外,nEV可以从各种生物中分离出来,快速装载所需药物进行修饰以进一步增强它们作为靶向药物递送载体的效用。这篇文章回顾nEV各方面,并讨论在选择nEV来源、药物装载方法和表面修饰策略时应考虑的参数,以及需要在临床应用中的全部潜力之前克服与nEV基于药物递送平台相关的挑战。
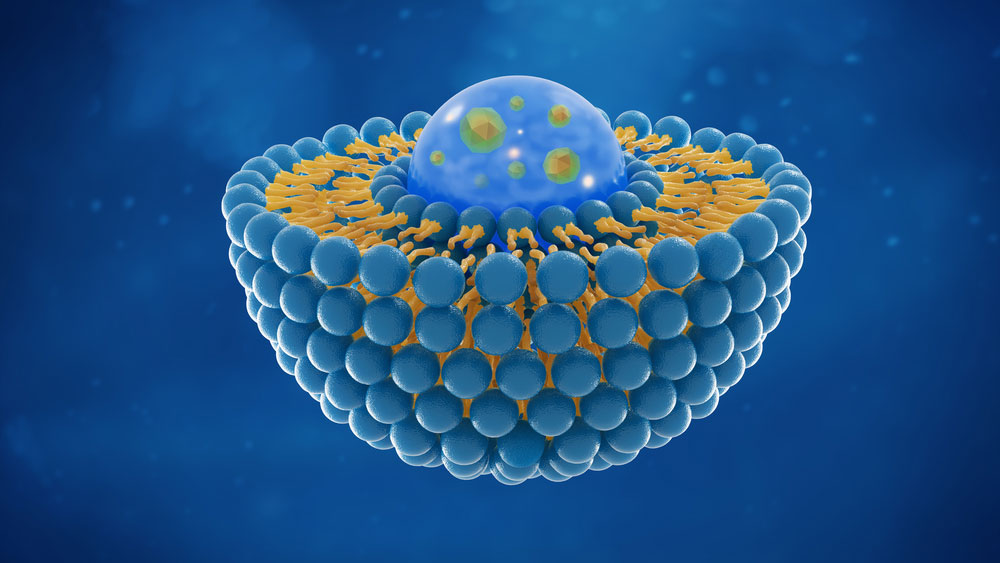
细胞外囊泡是什么?
细胞外囊泡(EV)是由真核细胞释放到细胞外空间的脂质双层膜颗粒。EV可以通过内细胞途径或通过膜出芽而产生。术语「外泌体(exosomes)」是指那些通过内吞途径形成的 EV,而「微囊泡(microvesicles)」是通过直接膜出芽释放的。外泌体和微囊泡的大小通常分别为30至100纳米和100至1000纳米。外泌体和微囊泡的大小分布不是很严格,可以根据生理条件的不同而变化。同样地,表面标记蛋白的表达也不是很严格。因此,国际细胞外囊泡学会(ISEV)建议应避免使用这些术语,除非有直接证据证明其生物生成。
大多数体液中都有EV存在的报道,包括尿液、唾液和血液。虽然最初被认为只是细胞释放的垃圾袋,以摆脱不需要的生物材料,但现在EV已被公认为是细胞间的沟通者,在细胞生物学中发挥着重要的功能作用。EV以旁分泌和自分泌的方式发挥作用,在附近或远处发挥其活性。EV的生物活性归因于其表面组成和携带的物质,其中包括脂质、核酸、蛋白质和代谢物。EV的组成和理化性质受供体细胞类型的影响,在病理生理条件下可以改变,导致其生物功能的改变。由于这些特性及其广泛存在于体液中,EV在生物标志物开发中的临床效用正被广泛探索。此外,由于EV作为生物信息载体的天然功能,其在药物递送方面的潜在效用也引起极大关注。
将药物有效地输送到目标部位仍是一项具有挑战性的任务。由于缺乏靶向性递送和快速的全身清除,大多数治疗性药物的疗效是有限的。因此,患者无法获得最佳的收益,并遭受不必要的短期或长期毒性。为了克服这些局限性,金属纳米粒子、脂质体和碳纳米管等合成载体系统已经被开发出来,但是它们的稳定性、生物相容性和长期安全性仍然是临床关注的问题。在这方面,纳米级细胞外囊泡(nEV)作为一种新兴的药物递送系统提供了很大希望。此外,nEV具有与受体细胞相互作用的特殊能力,并且由于其独特的膜组成,而具有选择性归巢
能力。
细胞外纳米囊泡的来源
虽然几乎所有类型的细胞都能产生nEV,但并不是所有的细胞衍生的nEV都适合用于人类治疗。作为药物载体的nEV应该有丰富的数量,并具有适当的表面蛋白成分,在传递时不会引起不良的免疫反应。人类肿瘤细胞、红血球、树突状细胞、间质干细胞、牛乳和植物汁或提取物已被用作分离用于药物装载和递送的nEV的来源。
肿瘤细胞
肿瘤细胞是一个令人瞩目的来源,用于分离用于药物递送的nEV,因其衍生的nEV携带肿瘤靶向表面蛋白。卵巢癌细胞衍生的nEV负载顺铂,在卵巢癌小鼠模型中被证明可以抑制肿瘤的生长。然而,由于肿瘤细胞衍生的nEV被证明会增强恶性行为,并由于肿瘤促进性货物和表面蛋白的组成而导致免疫抑制,因此其使用不被鼓励。重要的是,肿瘤细胞衍生的nEV可以抑制T细胞的效应功能,因为其表面带有PD-L1,与T细胞上表达的PD-1结合。
红血球
属于「O」组的人类红细胞(red blood cells,RBC)正在被探索作为用于治疗目的的nEV来源。红细胞可以从血库中大量获得。此外,为了避免由于细胞污染引起的任何不必要的免疫原性反应,RBC可以从同一个病人身上分离出来。通过用钙离子团、佛波醇-12-十四烷酰-13-乙酸酯,或溶血磷脂酸处理RBC,可以增加其nEV的分泌。在储存的小鼠RBC中加入抗坏血酸已被证明可以增加输血后的恢复,减少nEV的形成和释放。
树突状细胞
树突状细胞(dendritic cells,DC)是免疫系统中最有力的抗原呈递细胞。未成熟的树突状细胞(immature dendritic cells,imDC)衍生的nEV(imDC-nEV)已被探索用于药物递送,可以从健康捐赠者的外周血单核细胞(peripheral blood mononuclear cells,PBMC)中产生。imDC-nEV显示低水平的表面生物标志物,如MHC-I、MHC-II、CD86和CD40,可能会减少免疫反应,保护它们免受系统性清除。有人认为,从imDC释放的不同大小的nEV可能在T辅助细胞反应中具有不同的作用。大尺寸的nEV触发Th2细胞因子的分泌,而小尺寸的EV则诱导Th1细胞因子的分泌,这表明它们在nEV表面的物质内容和MHC分布上的差异。
间充质干细胞
间质干细胞(mesenchymal stem cells,MSC)已经成为一个很好的选择,因其可以从不同的组织,如脐带、骨髓和脂肪组织中有效分离出来。间充质干细胞也可以在体外扩增,可作为丰富的nEV来源。来自间充质干细胞的nEV不会产生任何不良影响,因为其非免疫性。然而,在某些情况下,间充质干细胞衍生的nEV被证明能增强受体细胞的增殖。也有人担心MSC-nEV也会促进肿瘤的血管化。相反,一些报告表明间充质干细胞衍生的nEV有抗肿瘤作用。显然这需要更多的研究来了解MSC衍生的nEV的不同作用。
牛奶
牛奶已经成为一个具有成本效益的、容易获得的、丰富的nEV来源。牛奶中的牛胚胎对消化液有抵抗力,并表现出跨物种的耐受性。nEV在装载疏水性和亲水性药物方面同样有效。在小鼠身上进行的一项研究表明,荧光标记的牛奶中的nEV注入小鼠体内后,在循环中稳定达6天。然而,需要进行广泛的研究以排除牛奶中的nEV作为药物载体的潜在毒性或朊病毒污染。
植物
从可食用的植物中提取可以产生大量的nEV,而且植物来源的nEV在口服制剂中不存在任何安全问题。植物在广泛的pH值范围内是稳定的,也可以作为几种病理状况的天然治疗剂。有趣的是,一些植物来源的nEV对某些类型的受体细胞表现出特异性。例如,从葡萄中提取的nEV被肠道干细胞特异性吸收,并抑制葡聚糖硫酸钠诱导的小鼠结肠炎。
药物包封方法
药物可以通过被动或主动的方法被封装到nEV中。被动的药物装载利用自然机制,而在主动装载中,采用外部物理(超声处理、挤压、冻融循环和电穿孔)或化学方法(使用皂素和点击化学)。主动装载货物会造成nEV膜的暂时破坏或拉伸,以允许药物的输入,并且比被动装载的效率高得多。
被动装载
被动装载是通过孵化药物来实现的,可以是nEV或供体细胞。一方面,药物直接扩散到nEV中是一个缓慢的过程,通过nEV的脂质层和药物之间的疏水作用得到促进。另一方面,当药物与供体细胞一起孵化时,它可以利用内源性细胞机制主动吸收,然后包装成nEV并释放到培养基中。为了将治疗性miRNA或肽包装成nEV,供体细胞可以用过量表达治疗性实体的质粒进行转染。然后供体细胞表达治疗药物,将其包装到nEV中,并将其释放到培养基中。负载药物的nave的吸收、包装和释放可以根据供体细胞的类型而变化。低剂量紫杉醇(paclitaxel,PTX)处理的SR4987间质细胞被证明可以产生PTX负载的nEV,产生抗胰腺癌的增殖活性。除化疗药物外,被动负载已被用于基于nEV的肿瘤病毒(oncolytic viruses,OV)的靶向递送。来自配体表达肝癌细胞的nEV封装了OV,并有效地递送到肿瘤部位,免受全身性清除。然而,这些方法的缺点是,它们很耗时。此外,药物的疏水性和内源性药物的驱逐机制也会对供体细胞的药物吸收和释放产生不利的影响。
主动装载
通过施加外部物理力或进行化学反应来实现药物分子在nEV内的主动装载。
超声处理
超声处理是利用声波的能量,主要是超声频率(>20 kHz)来搅动溶液中的颗粒。轻度超声处理可以瞬时破坏膜,以释放和吸收悬浮介质中的物质。为达到最佳的装载效果,循环频率和超声处理时间要根据被装载的药物类型来调整。在不影响完整性和理想的多分散指数和大小的情况下,用30秒脉冲/30秒暂停的六个循环超声处理,将honokiol最大限度地加载到nEV。另一项通过超声处理将PTX装入nEV的研究也有类似的观察。在某些情况下,超声处理会不经意地将药物连同内部的封装一起附着在nEV的外表面。锚定在外表面的药物被快速释放,随后是nEV内部负载的药物缓慢释放。
挤压
药物和nEV混合后装入带有100-400纳米多孔膜的脂质注射器挤出机,并用力推出。这个过程是在可控的温度下进行的,外泌体膜被暂时破坏,使药物的吸收成为可能。然而严重的机械力会永久性地破坏nEV膜,影响药物装载效率。还有一个风险是其他膜的特性也会以不理想的方式被改变。一方面,早期对培养的乳腺癌细胞衍生的nEV进行的研究表明,详尽的挤压确实对nEV的完整性和zeta电位产生了不必要的影响。另一方面,对来自RAW264.7巨噬细胞的nEV的较温和的挤压产生了最佳的过氧化氢酶负载,而不损害其完整性。然而,可以说在这两项研究中,nEV的来源和装载实体是不同的,因此需要进行更多的研究。
冷冻与解冻循环
这一过程很简单,不需要太多的技术技巧或专门的仪器。nEV和药物在室温下培养,然后将混合物在-80℃或液氮中快速冷冻。随后,混合物在室温下再次解冻,并重复这一过程以实现有效的装载。药物和nEV的比例、孵化时间和冻融循环的次数可以不同,需要针对不同的药物和nEV类型组合进行优化。冻融法也被用于磷脂基脂质体和nEV之间的膜融合,以创造出模拟外泌体的纳米颗粒。拟外泌体颗粒的生产不那么麻烦,而且在临床前或临床环境中使用时可以扩展。此外,融合的过程更加可控。不过,反复的冻融循环可以诱发nEV的聚集,并增加多分散指数,使载药的nEV具有广泛的尺寸分布,最终影响到药物的吸收效率。也有研究认为冻融法的载药率低于超声法或挤压法产生的载药率。
电穿孔法
传统上,电穿孔技术用于将DNA、RNA和药物引入细胞,但最近,它也被用来将miRNA/siRNA加载到nEV内。siRNA或miRNA是带电的,其大小比一些疏水药物如PTX要大,因此不能被动地在nEV内扩散。电穿孔法产生的电流在nEV的脂质双层膜上形成自发的孔隙,有利于siRNA/miRNA或药物向内移动。一旦加载过程完成,EV膜的完整性就会迅速恢复。由于电穿孔方法的暴露时间是在毫秒范围内,所以温度的上升非常小(每个脉冲上升1℃),避免了对电动车的任何热损伤。据研究,在电穿孔过程中,nEV的大小与应用的电场成比例增加。这种尺寸的增加可以用优化的缓冲液来控制,帮助保持nEV的完整性并防止其聚集。
皂素处理
皂素是一种表面活性剂分子,与膜胆固醇形成复合物。因此在与nEV孵化时,皂素在EV膜上产生孔隙,增加渗透性。与其他技术(如孵化和电穿孔)相比,皂素处理被证明是将药物封装到电动车中的一种实用方法。皂素方法的结果是高装载效率,而不对nEV的大小产生重大影响。实验表明,与被动方法相比,其能使亲水性卟啉的药物装载量明显提高。然而,这一方法也引发担忧,包括质疑体内溶血活性和皂素引起的受体细胞膜上的孔隙形成。因此,使用最低浓度的皂素和从溶液中完全去除皂素是在递送nEV之前的关键。
点击化学
铜催化的叠氮-炔基环化反应(即点击化学)方法被用来通过共价键将分子直接连接到nEV的表面。点击化学方法具有快速的反应时间,对共轭位点有更好的控制,并且在水性缓冲液中具有兼容性。在碳二亚胺介导的偶联作用下,nEV与炔基交联。通过与4-戊炔酸的羧基交联,一种荧光分子——叠氮-氟545,被有效地附着在4T1细胞衍生的nEV表面。nEV膜上的胺基促进了这种交联。重要的是,anazide-fluor 545与nave的结合并不影响受体细胞的大小和吸收。此外,使用无铜点击化学方法将带有叠氮基的nEV与靶向肽结合起来,以改善其对癌细胞的传递。
修饰细胞外纳米囊泡,以实现靶向给药
与其他药物和药物载体一样,nEV也容易通过肝脏和脾脏进行全身清除,这一点在小鼠的静脉注射中得到证实。作为先天免疫系统的重要组成部分,补体系统和免疫细胞,包括巨噬细胞,也参与了循环中的nEV的清除。循环中的nEV受其表面组成的制约,因其可能在其表面显示特定的抗原蛋白。为了解决这些限制,nEV的表面修饰是至关重要的。表面修饰也可以改善靶向药物输送,带来最佳的治疗反应,同时最大限度地减少药物引起的非预期的系统性毒性
效应。
操纵nEV 供体细胞
对供体细胞的操纵已经被作为一种间接策略来研究,以改变释放的nEV的表面。有研究操纵小鼠imDCs表达一种溶酶体相关的膜糖蛋白(Lamp2b)与αv整合素特异性iRGD肽融合。这些nEV后来被加载了阿霉素(DOX),并在小鼠体内静脉注射。nEV有效地将DOX输送到αv整合素阳性的乳腺癌细胞,并抑制其生长而不引起任何明显的毒性。在另一项研究中,HEK293细胞被强迫表达血小板衍生生长因子受体(PDGF-R)的跨膜结构与GE11肽融合,GE11肽是一种高亲和力的EGFR配体。释放的nEV在其表面携带这种肽,对表达EGFR的乳腺癌细胞表现出更大的亲和力。此外,在RAG2-/-小鼠中静脉注射这些nEV,以表达EGFR的乳腺肿瘤异种移植为目标,并传递let-7a miRNA。然而,这种供体细胞操作方法的一个重要限制是实现最佳和一致的转染效率,这依赖于供体细胞类型、转染试剂和质粒载体的
大小。
细胞外纳米囊泡的直接表面修饰
聚乙二醇化
用聚乙二醇(poly ethylene glycol,PEG)对纳米材料进行表面修饰,即聚乙二醇化(pegylation),是最广泛使用的方法,可以延长纳米材料在血液中的循环时间,从而提高生物利用率。负离子化在nEV的表面形成了一个水化层,减少了nEV作为外来物质的识别,从而防止nEV从循环中被清除。在一项研究中,来自小鼠神经母细胞瘤细胞的nEV被涂上PEG并静脉注射到小鼠体内。PEG涂层的nEV在循环中仍可检测到超过60分钟,而非PEG涂层的nave在10分钟内被迅速清除。在另一项研究中,RAW264.7巨噬细胞衍生的nEV与PEG涂层的脂质体融合,这导致其生物利用度增加。
pH反应性修饰
肿瘤细胞位于酸性的肿瘤微环境(tumor microenvironment,TME)中,通过在nEV表面引入对pH敏感的官能团,可以对其进行定向给药。有研究证明了通过在小鼠巨噬细胞RAW 264.7巨噬细胞表面加入3-(二乙基氨基)丙胺(HDEA)而产生的pH反应性nEV的优势。此外,HDEA结合的nEV被加载了抗肿瘤药物DOX。这些表面修饰的nEV有效地对低pH值作出反应,并积极地与HCT-116肿瘤细胞上的CD44受体结合,抑制了其在体外和体内的生长。在另一项研究中,DOX通过一个pH值可破坏的亚胺键与牛乳来源的nEV共轭,在酸性微环境下解离。在体外的酸性条件下,改性的nEV显示了DOX的可控释放,并减少了小鼠鳞状细胞癌的生长。
聚糖修饰
内源性的表面分子,如聚糖,基于电荷的相互作用或模式识别,或两者兼而有之,来介导nEV的靶向和吸收。有研究通过神经氨酸酶处理,从来自小鼠肺部细胞的nEV表面去除西亚里酸,去除唾液酸减少了nEV的负电荷,增强了其与肺细胞的相互作用,导致小鼠静脉注射后在肺部的积累增加。在另一项研究中,牛血清来源的nEV被α-d-甘露糖表面修饰。在小鼠皮内给药后,在淋巴结中观察到更多的甘露糖修饰的nEV。这些研究为探索 nEV 表面的聚糖修饰作为选择性递送药物到预定位点的策略提供了理论基础。
结论和未来展望
由于其强大的生物相容性,自然界中的nEV正在成为治疗各种疾病的下一代药物输送系统。使用不同生物来源的nEV的配方正在临床前模型中进行疗效测试,最近还在进行临床试验。然而,在使用nEV时也有一些限制。例如,从自体来源获得所需数量的外泌体往往可能很困难。此外,自体nEV,例如来自患者肿瘤细胞的nEV,由于其固有的生物活性,可能会带来免疫抑制和化疗抵抗的担忧。此外,由于这些nEV的可用性有限,自体nEV的安全性和疗效无法在临床试验中得到评估。有效地将药物加载到nEV中也是一个问题,可能会受到nEV的质量和纯度的影响。因此,找到一个可接受的nEV来源,并开发一个能大规模提供纯净和完整nEV的分离方法是非常重要的。未来的研究需要集中在从可靠的异体来源生产大量的具有高负荷能力的特征性的nEV,还应集中精力开发定制nEV的方法,以提高其归巢能力,并实现所需的细胞内包封药物。
预计未来几年将见证EV领域的重大进展,以及EV在疾病诊断和治疗中的应用。生物学、化学和纳米技术的进步正在不断发生,将有助于解决目前的障碍。新的疾病模型正在开发中,可以更准确地提供关于纳米EV药物输送系统的疗效和安全性的临床前数据。随着更多系统的体内研究和对nEV的分离、药物装载和工程的不断改进,在不远的将来,把这些有吸引力的药物输送工具带到临床实践中的潜力
很大。
作者:Sachin Kumar Deshmukh,Mohammad Aslam Khan,Seema Singh,Ajay Pratap Singh
来源:ACS omega 6.3 (2021): 1773-1779.
编译:John Xie
来源:荣格-《国际医药商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。