荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
在认识人体器官功能的初期,人们就认识到皮肤是我们身体和环境之间的屏障。因此,很明显,皮肤会阻碍化合物的渗透,抵御外界的侵入。基于这一特性,很容易理解皮肤的上层角质层(SC)是一种非常有效的限制化合物渗透的亚组织。多年来,科学家们一直试图找到能够克服这一障碍并与更深层次的亚组织相互作用或允许向循环系统渗透的化合物或系统。经过多年的研究,现在的认识已经非常透彻,即可以采取一定的方式让化合物渗透到皮肤内并透过皮肤。目前研究的焦点已经转移到了解皮肤的微结构,以及这些促渗方式的作用机制上。
由于皮肤促渗剂会引起角质层的结构变化,因此通常会引发刺激、过敏或炎症等不良免疫系统反应。大多数促渗剂都是非特异性的,可以渗透小而亲油的化合物。这也意味着,在化妆品配方中,香精成分和防腐剂等化合物将与活性成分一起渗透。此外,皮肤是一个非常活跃的组织,它参与多种新陈代谢作用,基本作用是参与和促进皮肤的生理过程,如角质层脱落、细胞外板层的形成、细胞程序性死亡(凋亡)以及皮脂或汗液的分泌等。此外,皮肤中和表面代谢的一些酶可能会在活性或非活性化合物渗透时与其作用,并将它们转化为非活性、活性或有毒的形式。因此,人们相信,通过了解渗透促进剂与皮肤相互作用的细节,可以找到避免其缺点或克服它们局限性的方法。
本文将回顾化合物渗透皮肤并与之相互作用的可能方式。同时讨论四类促进剂,以及它们可能的作用机制和局限性。这篇文章的目的是为了激发人们对研究工作的创造性思考,以便更好地理解皮肤,设计治疗和保护皮肤的配方或制剂。
在设计外用配方时,首先必须了解配方与皮肤之间可能存在的相互作用。本文试图对这一问题有一个初步的阐述。皮肤渗透(Penetration)不同于皮肤扩散 (Permeation),前者描述了一种成分进入皮肤的过程,即到达目标皮肤层,这是我们所期待的。后者描述了一种成分通过皮肤进入循环系统的过程,例如在药物透皮系统中。然而,很难区分这两种术语,因为一旦化合物通过角质层的限制,到达具有生理活性的表皮部分,几乎不可能再阻止它进入到皮肤亚组织结构,包括进入循环系统的血管。这两个术语都将在本文中遇到,并根据这些定义使用。
影响皮肤渗透的因素
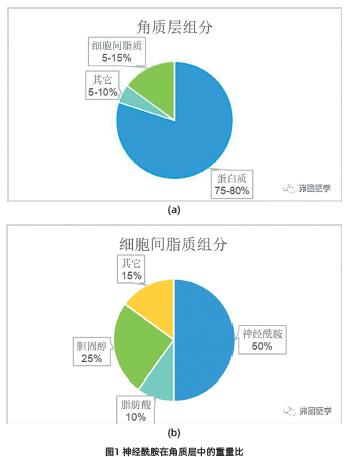
角质层是一个非均质的结构,在显微镜下观察可发现,表皮的上部细胞,即角质细胞,排列成柱状并形成簇。角质层由交替的细胞层和脂质层组成,厚度仅为6-10μm,约相当于14-18层细胞。角质化细胞通常厚200-300纳米,直径30-50微米,形状为六边形或多边形。角质层的屏障性质由其成分决定:75%-80%是蛋白质,5%-15%是脂质,5%-10%是未知成分(图1)。这种组合物有利于某些脂溶性化合物被皮肤吸收。为了简化化合物通过皮肤的渗透曲线的计算,科学家采用简单扩散模型来解释化合物通过角质层类脂域的流量。在使用这个模型时,假设给定的化合物与皮肤之间的相互作用本质上符合物理化学的基本属性,角质层内的角质细胞的多层结构是水平组织的。大多数穿过表皮的分子将通过细胞间途径渗透到细胞之间。化合物的渗透必须先进入角质层,然后才能扩散到具有生理活性的表皮。因此,化合物的主要途径高度依赖于其分配系数,亲水性化合物可以优先分配到细胞内域,而亲脂性化合物可以通过细胞间途径穿过角质层。事实上,尽管化合物的性质决定了其首选的渗透路径,但大多数分子同时通过这两条路径穿过角质层。
可能影响渗透的因素包括化合物分子的大小,它与皮肤表面的亲和力,以及它与细胞间脂质的相容性。对渗透有重要影响的因素还包括皮肤状况、水分含量、温度、角质层的厚度(不同种族和身体部位可能不同),以及角质层完整性。角质层完整性可能会受到年龄、溶剂、常规的皮肤护理方式、健康状况和环境因素的影响。
通常可以参照辛醇和水之间的化合物分配值(即分配系数)与其假定的皮肤渗透路线之间建立关联。研究结果表明,甘露醇主要通过极性途径渗透,氢化可的松主要通过脂质途径渗透,黄体酮主要通过脂质途径渗透,亲水层对其渗透速率有影响。这些结果与化合物的辛醇-水分配系数有关。2
在考虑极性和非极性途径进行渗透时,通常假设极性化合物将通过极性途径渗透,而非极性化合物倾向于亲脂途径。细胞间途径:经角质层的角质化细胞之间的渗透是大多数化合物穿透皮肤的途径,由于角质细胞在各层之间不是平行堆积的,所以在化合物穿过角质细胞各层之间时,由一条蜿蜒的路径通过。通常认为这一途径能够通过存在于细胞之间的脂质双层实现自由扩散。
大多数皮肤促渗剂会影响细胞间脂质双层,如二甲基亚砜(DMSO)、月桂氮卓酮(Azone)、乙二醇和表面活性剂等皮肤促渗剂通过可逆地降低细胞间脂质双层的扩散阻力来促进皮肤的渗透。3 这些促进剂不仅可以作为溶解细胞间脂质的溶剂,还可以影响细胞间桥粒连接或干扰产生细胞间脂质双层所需的代谢活性。3 在正常皮肤条件下,对脂质双层结构的影响是可逆的。脂质双层抗穿透能力的降低可能是由于流体的热力学效应(脂质的转变温度降低),也可能是由于细胞间隙中脂质的相分离引起的。
毛囊内途径:皮脂腺在整个皮肤表面的数量不超过0.1%,因此有科学家认为这条途径对大多数分子来说不是一个重要的渗透途径。而另一部分专家声称,这些附属物可以绕过角质层的低扩散系数,并可能起到扩散分流的作用。当毛囊作为发挥作用的部位时,例如在痤疮中,科学家通过开发具有特定理化特性的输送系统,找到将一种化合物靶向毛囊的方法。4
当考虑将毛囊作为可能的渗透途径时,需要了解毛囊在不同身体部位之间的分布差异。4 毛囊密度和毛囊开口的百分比最高的部位是额头;小腿上毛囊卵泡口的平均大小最大;前额和小腿区域的漏斗体积最大,因此形成皮脂腺的潜力最大,而所有参数的最低值都出现在前臂;皮肤的足底和掌部是完全没有皮脂腺的部位。
由于缺乏合适的动物模型,很难研究通过毛囊的渗透。现已开发出一种技术以区分经分流途径渗透还是大量的经表皮渗透的方法,该方法将通过表皮作为膜的传递与通过角质层和表皮的“三明治“传递进行比较。毛囊呈层状存在,很少重叠。该模型假设毛囊叠加的可能性很小,因此皮肤顶层的底部会阻挡毛囊的开口。因此,它允许人们区分这两种渗透方式。如果穿透毛囊占主导地位,与单独穿过表皮膜相比,”三明治”模型的穿透将显著减少。5
另一种评估分流穿透性的方法是通过瘢痕皮肤和正常皮肤进行比较。在瘢痕皮肤中观察到的主要改变包括毛囊和皮脂腺的缺失以及胶原纤维变薄。6 该项研究中观察了4种类固醇在瘢痕皮肤和正常皮肤中的经皮吸收。实验结果表明,人体皮肤附件、毛囊和皮脂腺是类固醇渗透的重要途径,因此很可能也是其他分子性质相似的化学物质的渗透途径。研究结果还显示,与正常皮肤相比,类固醇往往会在无附属物的瘢痕皮肤的角质层中产生更多的累积。在正常皮肤中,表皮和真皮中出现的类固醇浓度较高,这些开口起到了允许更深渗透的作用。微囊输送系统可能通过分子靶向于毛囊方面从而发挥作用。根据配方和化合物的内在特性,某些化合物进入分流管的速度比通过角质层中的不同路径更快。例如,研究表明,最佳粒径大小约为1.5μm的微囊具有55%的毛囊渗透率。7
两种类型的脂质体(经典的多层囊泡和柔性的超变形脂质体)对分流途径的渗透有显著的促进作用。
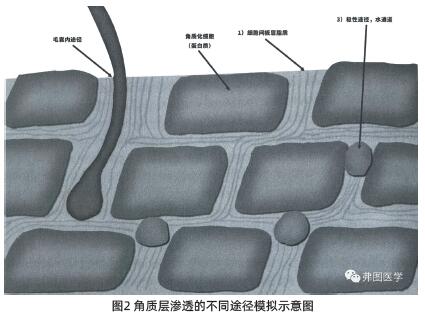
“极化路径”:这条路径通常认为是亲水性的,它由被极性脂质包围的亲水材料组成,形成微通道的壁(见图2)。众所周知,它对亲脂性化合物具有很高的穿透性,但对亲水性化合物的抵抗力很低。它也是水分通过皮肤蒸发的途径。亲水性毛孔的定位目前尚不清楚,虽然一些科学家声称,通过这一途径渗透的化合物将通过形成由水组成的开口的缺陷穿透角膜细胞团之间,但也有科学家认为,细胞内的角蛋白提供了这一途径。可能这两条路径同时存在,并且穿透的首选路径是基于分子属性和所使用的测试模型的函数。
支持第一种理论的证据是一项关于巴氯芬通过身体皮肤屏障的研究,该研究表明,极性途径是细胞间的,由被极性脂质包围的水区组成。9
利用荧光超变形脂质微管和激光共聚焦显微镜技术,可以将完整皮肤的穿透途径进行可视化。1 实验中观察到3~10个角质化细胞形成“柱状”,形成一个簇,每个簇内角质化细胞边缘广泛嵌插,相邻簇之间仅有几个微米的间隙,簇间脂质堆积较簇内堆积规则。这项技术还可以量化两种不同的亲水途径:低渗透阻力的簇间途径约占总途径面积的1%,或约占皮肤途径面积的20%。表现出较高穿透阻力的角质细胞间通路约占皮肤面积的3%,或通路面积的80%。由于后一条路径在成簇的角质化细胞之间穿行,由于细胞间脂质层和/或可能在皮肤中充当虚拟通道的相邻角质化细胞包膜之间的不规则性,因此这条路径是曲折的。
促进皮肤渗透的方法
有多种方法可以区分和分类皮肤渗透促进剂,既可以根据它们携带不同分子的能力也可以根据它们的促渗机制进行分类。另一个区别是他们首选的渗透途径。根据这种分类可将促渗剂分为三大类:2
促进极性和非极性途径渗透的溶剂,如2-吡咯烷酮、N-甲基吡咯烷酮、N-甲基甲酰胺和丙二醇与氮酮联合使用;
优先影响极性路线的促渗剂,如丙二醇与癸基甲基亚砜复配;
主要对非极性路线进行改性的促渗剂,如丙二醇和油酸、丙二醇单独使用或与适量的水配制。
促渗剂通过三种主要的机制促进极性分子的运输:8
● 提取角质层脂质
● 诱导角质形成细胞胞质基质的聚合结构松弛
● 改变角质层的溶剂性质
例如,表面活性剂通过溶解和去除细胞间脂质以及与细胞内基质的角蛋白纤维结合来增强极性分子的运输,这也会导致细胞秩序受到破坏。非离子表面活性剂对超临界流体有流变作用。用含有各种非离子表面活性剂的凝胶预处理的皮肤显示出松散的角质层和宽大的细胞间隙。9
皮肤促渗剂在结构、性质和作用机制上各不相同,在下面对酶、化学促渗剂、泡囊系统和神经酰胺的论述中将进一步讨论。
酶:使用酶来影响角质层屏障特性的方法是指通过影响皮肤中存在的酶的活性,或者是从外部施加到皮肤上的酶的方式。
角质层中的三种主要脂质类(脂肪酸、胆固醇和神经酰胺)都是正常屏障功能所必需的,抑制其中任何一种成分的产生都可以延缓屏障损伤后屏障的恢复。10 抑制脂肪酸合成(用5-(十四氧基)-2-呋喃甲酸)或胆固醇(用氟伐他汀)可增加利多卡因的经皮吸收。在应用常规化学促渗剂后,调节表皮脂质生物合成可进一步增加化合物的经皮吸收,同时干扰屏障稳态和热力学特性。
通过创造可控的代谢干扰类似效果,为酶应用于皮肤提供了理论基础。根据不同的酶的生物学功能,可以影响皮肤中的新陈代谢和生化级联反应,最终允许化合物渗透。例如,应用木瓜蛋白酶(一种与角质层-葡聚糖结合的蛋白水解酶)可以促进经皮吸收。这种应用可引起角质层的结构变化,促进角质层和生理活性表皮层的厚度增加。应用该酶还可诱导角质层的亚组织相分离、板层小体的形成和板层结构的紊乱。因此,可推测这些结构变化是由于角质细胞膜和细胞内蛋白的交联水解所致,角质层-葡聚糖-木瓜碱结合物对皮肤无刺激性。11
化学促渗剂:这类成分可能是数量和被研究最多的一组促渗剂,主要用于透皮吸收。大多数化学促渗剂影响角质层中的细胞间脂质结构。它们可引起双层结构的可逆变形,从而允许在脂质双层中产生各种类型的“通道”。这些“通道”的性质可能会有所不同。同时,化学促渗剂还可以触发脂质区域内的热力学失衡,并导致脂质流动性增加或在显微镜下产生实际的可视毛孔。
众所周知,多种酯和脂肪醇都可促进皮肤渗透。例如肉豆蔻酸异丙酯和异丙醇。已证明两者都能增加皮肤的渗透性。当它们一起使用时,表现出协同促进渗透的作用,而且他们的作用机制也不尽相同。肉豆蔻酸异丙酯在与角膜细胞结合的脂质中产生无序的双层结构,而异丙醇则导致细胞间脂质的自由双层结构的流变性改变和紊乱。13
当联合使用两种或两种以上的皮肤渗透促进剂以改善皮肤渗透时,建议选择作用机理不同的促渗剂。这将防止作用部位的竞争,并有更好的可能性不会引起刺激。油酸是通过促进皮肤通透性的方式增加表皮的渗透性。13 使用电子显微镜和四氧化三钌的电子显微镜技术,可以在应用油酸后对角质层进行超微结构检查,可观察到角质层发生了明显的改变,特别是在细胞间隙中。
囊泡系统:囊泡是微球,通常由两亲分子组成。经典的脂质体是由磷脂组成的。局部使用的囊泡既可以与角质层脂质基质混合,也可以通过细胞间基质的脂质-水界面穿透角质层。推动囊泡穿透皮肤的一个主要作用力可能是表皮上的水分浓度梯度。14
当对经典卵磷脂来源的囊泡与角质层衍生的囊泡进行效果对比时,科学家们称有两种不同的截然相反的作用。大多数研究表明,经典的多层磷脂脂质体会产生皮肤储存库,不会成为透皮给药的首选载体。另一方面,与传统的卵磷脂脂质体相比,15 角质层脂质体运载了更多的放射性标记物到达皮肤深层(表皮和真皮)。经典脂质体也能显著降低标记物的全身吸收,减少器官分布。脂质体的大小是渗透的关键因素。平均粒径越大,对角质层的渗透性越差。16
但是,在另一项研究中发现了彼此相矛盾的证据,即由磷脂形成的脂质体与由模拟角质层(神经酰胺、胆固醇、棕榈酸和胆固醇硫酸盐)的脂质组成的脂质体进行了比较。17 在该研究中,磷脂复合脂质体可增加角质层脂质双层紊乱,增加经皮渗透。模拟角质层脂质衍生脂质体对角质层有很高的亲和力,并产生储存库。同时观察到这些脂质体还能增加细胞间质中脂质的有序排列。
神经酰胺:角质层神经酰胺是维持皮肤屏障的基础。大多数神经酰胺及其类似物有助于修复受损的皮肤屏障,从而降低皮肤通透性。
洞悉神经酰胺在皮肤上的应用效果对于达到预期作用至关重要。虽然使用特定浓度的神经酰胺,特别是与脂肪酸和胆固醇联合使用,可以帮助改善皮肤屏障的抵抗力,但有证据显示某些浓度的神经酰胺会造成细胞间板层结构的失衡,并增强皮肤的穿透性。
在一项为了解促渗剂的化学结构与其促渗效果之间的相关性而进行的研究中,发现在某些情况下,促渗剂的极性头部负责分子对SC的穿透和锚定。18 用支链醇作为皮肤渗透促进剂进行的这项研究表明,支链醇比相同分子量的伯醇具有更低的促透能力。结论是,烷基链的分支降低了增强剂影响靶部位SC片层中脂质流态化的能力。
对一系列神经酰胺类似物进行的类似研究进一步支持了这一发现。19 这些类似物包括不同的极性头基和不同的链长。在这里,具有相同链长的神经酰胺表现出仅依赖于其渗透系数的增强活性,发现神经酰胺的氢键能力与促渗能力成反比。同一组科学家还研究了基于L-丝氨酸和甘氨酸的神经酰胺类似物作为与角质层神经酰胺相关的渗透促进剂。以甘氨酸为基础的神经酰胺类似物被证明能显著促进茶碱在离体人体皮肤中的渗透。
神经酰胺NS
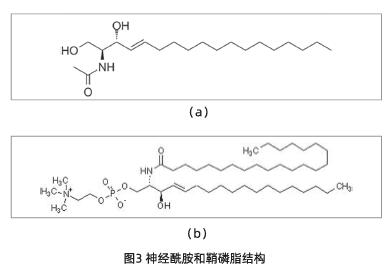
神经酰胺NS,通常也被称为神经酰胺2,以及它的类似物正被用作治疗干燥、鳞屑病的外用制剂。据说NS还可延缓皮肤老化。含有神经酰胺NS的制剂可支持和增强皮肤屏障特性。角质层神经酰胺的所有主要亚组分在一定程度上都是由板层小体衍生的葡萄糖神经酰胺产生的。然而,研究表明,鞘磷脂衍生的神经酰胺是正常屏障稳态所必需的。此外,鞘磷脂可以由两个来源产生神经酰胺:质膜和板层小体。表皮鞘磷脂SM-1(图3)是神经酰胺NS的重要前体。20
神经酰胺NS具有抑制细胞增殖和诱导细胞凋亡的作用。鞘磷脂的水解产生神经酰胺NS,神经酰胺NS负责凋亡小体的形成。细胞凋亡是细胞程序性死亡的活跃过程,它需要死细胞的新陈代谢活动,通常以DNA裂解为碎片为特征。当成熟细胞的生命周期结束时,诱导凋亡是必不可缺的过程,因为皮肤是一个不断更新的组织,所以必须保持一个“生死”循环,为新的、新鲜的细胞扫清道路。21
合成神经酰胺NS的类似物,即类神经酰胺2(N-硬脂酰基-DL-红鞘氨酸)处理剥离或用十二烷基硫酸钠的皮肤可显著降低处理部位的TEWL值。该类似物在乳膏中通常使用量为0.5%到1%的水平。本研究结果提示,这些NS神经酰胺类似物参与角质层的重建。22 众所周知,在清洁皮肤的同时,洗涤剂可能会清除宝贵的皮脂,从而破坏表皮屏障功能,提高TEWL。
神经酰胺NS含量
经5%十二烷基硫酸钠处理后,测定单甘酯、角鲨烯、胆固醇酯和类神经酰胺2对TEWL的影响,其中单甘酯和神经酰胺2恢复屏障功能的效果最好。结论:在洁肤剂配方中添加神经酰胺NS对防止洗涤剂引起的屏障破坏有一定的作用。当将神经酰胺NS应用于皮肤时,神经酰胺NS可以在酶作用下转化为其他神经酰胺,从而提供更好的屏障性能。为了实现有效的酶识别,神经酰胺NS必须是具有光学活性的纯净形式。
总结与展望
尽管如本文所述,人们可以区分具有不同性质的不同渗透途径,但大多数应用于皮肤的化合物可通过不止一种途径渗透。然而,根据该化合物的特性及其载体的不同,可能会显示出一种较好的渗透路线。尽管如此,仍然需要模拟角质层的模型以及能够跟踪应用于角质层的化合物的技术。在研究化合物的渗透性能时,了解其可能的渗透途径至关重要。如果改变其分子性质,选择输送系统或载体配方,可以改变其首选的渗透路线。了解可能的渗透途径可以为设计适当的输送系统提供理论依据,从而将分子输送到期望的作用目标。
1.A Schatzlein and G Cevc,Non-uniform cellular packing of the SC and permeability barrier
function of intact skin: A high resolution confocal laser scanning microscopy study using
highly deformable vesicles(Transferosomes),Br J Dermatol 138 583-592(1998)
2. BW Barry and SL Bennett, Effect of penetration enhancers on the permeation of mannitol,
hydrocortisone and progesterone through human skin,J Pharm Pharmacol 39 535-546(1987)
3.AC Wiliams and BW Bary,Penetration enhancers,Adv Drug Deliv Rev 56 603-618(2004)
4. N Otberg,H Richter,H Schaefer,U Blume-Peytavi,W Sterry and A Laderman,Variations of hair
follicle size and distribution in different body sites,J Invest Dermato/ 122 14-19(2004)
5. BW Bary,Drug delivery routes in skin: a novel approach,Adv Drug Deliv Rev 54 S31-S40(2002)
6. F Hueber,H Schaefer and J Wepierre,Role of transepidermal and transfollicular routes in percuta-
neous absorption of steroids: in vitro studies on human skin, Skin Pharmacol 7 237-244(1994)
7. R Toll,U Jacobi,H Richter,J Ladermann,H Schaefer,U Blume-Peytavi,and U Peytavi,
Penetration profile of microspheres into follicular targeting of terminal hair follicles,J Invest
Dermato/ 123 168-176(2004)
8. M Sznitowska,S Janicki and AC Williams, Intracellular or intercellular localization of the
polar pathway of penetration across SC, J Pharm Sci 87 1109-1114(1998)
9. SC Shin, CW Cho and IJ Oh, Effects of non-ionic surfactants as permeation enhancers
towards piroxicam from the poloxamer gel through rat skins, Int J Pharm 17 199-203(2001)
10. JC Tsai,RH Guy,CR Thronfeldt, WN Gao, KR Feingold and PM Elias, Metabolic
approaches to enhance transdermal drug delivery - effect of lipid synthesis inhibitors,
J Pharm Sci 85 643-348(1996)
11. YC Sim, YS Nam, YH Sjin, E Shin, S Kim, IS Chang and JS Rhee, Proteolytic enzyme
Conjugated to SC-glucan as an enzymatic transdermal drug penetration enhancer,
Pharmazie 58 252-256(2003)
12.I Brinkman and CC Muller-Goymann,Role of isopropyl myristate, iso propyl alcohol and a
combination of both in hydrocortisone permeation across the human SC,Skin Pharmacol
App/ Skin Physiol 16 393-404 (2003)
13.SJ Jiang and XJ Zhou, Examination of the mechanism of oleic acid enhanced percutaneous
penetration enhancement: an ultrastructural study, Biol Pharm Bull 26 66-68(2003)
14. DB Yarosh, Liposomes in investigative dermatology. Photodermatol Photoimmunol
Photomed 17 203-212(2001)
15.N Dayan and E Touitou, Carriers for skin delivery of Triethexyphenidyl HCI: Ethosomes vs.
liposomes. Biomaterials 21 (18)1879-1885(2000)
16. M Fresta and G Puglisi,Application of liposomes as potential cutaneous drug delivery
system - in vitro and in vivo investigation with radioactively labeled vesicles, J Drug Target 4
95-101(1996)
17.L Coderch,M de Pera,N Perez-Cullell, J Estelrich, A de la Maza and JL Parra, The effect of
liposomes on skin barrier structure, Skin Pharmacol App/ Skin Physiol 12 235-246(1999)
18. D Chantasart,SK Li,N He, KS Warner, S Prakongpan and WI Higuchi,Mechanistic studies
of branched-chain alkanols as skin permeation enhancers, J Pharm Sci 93 762-779 (2004)
19. K Vavrova, A Harbalek,P Dolezal, L Samalova, K Palat, J Zbytovska, T Holas and J
Klimentova,Synthetic ceramide analogues as skin permeation enhancers: structure-activity
relationships, Bioorg Med Chem 11 5381-5390(2003)
20.K Vavrova, A Hrabalek, P Dolezal, T Holas and J Zbytovska, L-Serine and glycine based
ceramide analogues as transdermal permeation enhancers: polar head size and hydrogen
bonding,Bioorg Med Chem Lett 13 2351-2353 (2003)
21. A Di Nardo,L Benassi,C Magnoni, A Cossarizza, S Seidenari and A Giannetti,Ceramide 2
(N-acetyl sphingosine) is associated with reduction in Bcl-2 protein levels by western blotting
and with apoptosis in cultured human keratinocyes,Br J Dermatol 143 491-497(2000)
22. K Lintner, P Mondon,F Girard and C Gibaud,Effect of a synthetic ceramide-2 on
transepidermal water loss after stripping or sodium lauryl sulfate treatment: in vivo study, Intl
J of Cosmet Sci 19 15-25(1997)
来源:荣格-《国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。