荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
解读2020新药典首增的《生物制品病毒安全性控制》章节

作者:高飞
(高飞博士2009年毕业于中国科学院过程工程研究所生化工程国家重点实验室。现任默克BioReliance®检测服务高级技术专家,为大中华区客户提供专业的技术法规咨询和项目实施方案。高飞博士拥有10年以上的专业经验,曾任GE Fasttrak下游团队经理,中国科学院过程工程研究所,副研究员。)
针对生物制品的病毒安全控制,2020药典给出了权威的指导原则,详见新增章节《生物制品病毒安全性控制》。对于生物制药行业,这绝对是喜大普奔的好消息。至此,中国药典不仅仅持平国际标准,更在一定程度上超越了目前的国际水平,开始引领法规沿革的大趋势。
2020年1月,国家药监局发布了《关于适用《Q2(R1):分析方法论证:正文和方法学》等11个国际人用药品注册技术协调会指导原则的公告(2020年第7号)》。公告指出:本公告发布之日起6个月后开始的药学研究(以试验记录时间点为准),适用ICH指导原则。
在7号公告后,业内讨论最多的,是对除病毒验证方案的影响。因为在此之前,为迎合国内和国外法规的要求,无论是IND(Investigational New Drug)还是BLA(Biologic License Application)阶段的除病毒验证,都是需要准备两套方案的。
国内除病毒验证方案,之前都是遵循CDE(国家药品监督管理局药品审评中心)2005年颁布的《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》。该原则与ICH的国际标准,在验证批次和模型病毒选择上有不同的要求。
2020年5月6日,CDE颁布《新型冠状病毒中和抗体类药物技术资料要求(药学)(征求意见稿)》。针对除病毒验证,明确指出:在符合ICH通行指导原则的前提下,允许临床试验申请时采用1个GMP 批次开展病毒去除灭活验证研究,每个步骤的病毒清除能力应至少由两次独立的研究加以重复验证。
众志成城抗击疫情,危机时刻践行ICH指导原则,切切实实加速抗病毒药物的研发。只是“1个GMP批次“的要求,搞得人一头雾水。要知道全世界的除病毒验证,都只是遵照GLP的实验标准,从来都没有GMP的要求。本文也会解读一下这一点。
在本文中,默克将从病毒清除验证批次、模型病毒选择、基因治疗病毒安全性控制、色谱法、病毒清除验证关键工艺参数设定和病毒清除新技术等热点话题进行一一解读。
模型病毒的选择
“一个典型的验证研究所选择的病毒,至少应包括单链和双链的RNA及DNA、脂包膜和非脂包膜、强和弱抵抗力、大和小颗粒等病毒。”
——2005CDE指导原则
“评价病毒清除的总能力时,应选择具有不同特性的非特异性模型病毒,包括DNA/RNA、有/无包膜、颗粒大小、尤其对物理/化学处理明显耐受的病毒等。”
——2020中国药典

区别何在?
细心的小伙伴一定发现了,2020版药典去掉了“单链和双链”的描述。ICHQ5A在模型病毒附录中,也没有区分单链和双链DNA/RNA病毒。
常见的下游纯化工艺,一般包括层析、过滤、低pH孵育等单元操作,通常不包含直接作用于DNA或RNA分子的单元步骤。从纯化原料角度出发,病毒的核酸分子无论是单链还是双链,都不会影响纯化工艺的除病毒效果。
以单抗工艺为例,用于病毒清除验证的模型病毒一般包括:小鼠白血病毒MLV(单链RNA), 伪狂犬病毒PRV(双链DNA),呼肠孤病毒Reo3(双链RNA),鼠细小病毒MVM(单链DNA)。在BLA阶段的除病毒验证,选择4种病毒是没有争议的。但在IND阶段,国际惯例只包含MLV和MVM两种。以前面对国内(中国)IND申报,只有选择4种病毒才能满足CDE的指导原则。但如果不在纠结“单链和双链“,似乎MLV和MVM两种也足够了。
目前,提供除病毒验证服务的供应商,面对国内(中国)IND申报的需求,还是推荐4种模型病毒的设计。虽然07号公告说,ICH原则“适用“,但是并未指出2005 CDE指导原则”不再适用“。面对不同的法规要求,一般原则是就高不就低。毕竟法规是最基础的要求(minimal requirement)。
相比吃螃蟹,吃瓜还是更稳妥吧。
验证批次
相对于模型病毒选择的模棱两可,业内已经普遍采用更少的批次开展IND阶段的除病毒验证。对于BLA阶段的验证,目前大部分还是沿用三批样本验证。只有加速申报的项目采用一批样本,进行重复实验。
前面提到《新型冠状病毒中和抗体类药物技术资料要求(药学)(征求意见稿)》首次提出“1个GMP 批次开展病毒去除灭活验证研究”。此前,从未有法规要求使用GMP批次的样品开展除病毒验证,无论是IND还是BLA阶段的除病毒验证,仅仅是部分供应商的过分解读。因为所有的验证实验都是在GLP条件下开展的,没有必要要求GMP样品。如果要等待GMP批次样品用于除病毒验证,必然会延后申报进度。
然而,为何在疫情期间,CDE对新冠中和抗体提出“1个GMP批次”的要求呢?权威专家的解读,是要避免药企蹭热点,只拿批件,而不想付诸生产。疫情期间CDE建立了“研申联动”的工作机制,申请人可根据阶段性研究进展滚动提交资料,已经极大提高了审批速度。
从长远来看,减少验证批次已经是大势所趋。无论是使用一批样本进行重复实验,还是使用两个批次的样本进行单次实验,从ICH指导思想来看,是没有差别的。至于GMP批次样本的要求,可以认为是疫情期间的特例。
新增“基因治疗产品的病毒安全性控制”
《生物制品病毒安全性控制》开篇提出“基因治疗产品的病毒安全性控制”,成为本次药典更新的创新之处。在2020年6月,PDA Virusand TSE Safety Forum 会议上,EMEA的法规专家才开始讨论基因治疗产品的病毒安全性,认为应该在ICH指导原则中添加相应条款。
“基因治疗产品的病毒安全性控制”,特别是针对病毒清除的要求,已经刊印在2020版中国药典里。全世界从事基因治疗产品的生产商,在走向国际市场的时候,都必须遵照中国药典的要求。EMEA和FDA的药典沿革,也需要认真“抄作业“了。
根据药典最新要求:“采用病毒为载体的基因治疗产品,还应建立与病毒载体特性及生产工艺特点相适应的病毒风险评估和控制要求,对非复制型病毒载体生产工艺应关注产生复制型病毒的风险和控制,复制型病毒载体生产应关注产生野生型病毒的风险和控制,生产过程中使用辅助病毒的,应评估和验证生产工艺对辅助病毒的清除能力”。
因为作为基因载体的病毒颗粒,在扩增过程中,具有回复到野生的可能,虽然发生频率极低,但仍然需要高灵敏检测技术来控制风险。
因此,申请进入临床的基因治疗产品,都需要检测具有复制能力的病毒颗粒(Replication competent virus),具体可包括具有复制能力的:Retrovirus(RCR) 逆转录病毒,Lentivirus (RCL) 慢病毒,AAV (rcAAV) 腺相关病毒,HSV (rcHSV) 疱疹病毒, Adenovirus (RCA) 腺病毒等。
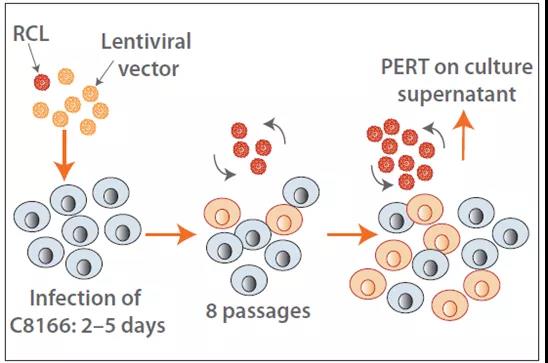
“如可行,应评估病毒载体纯化工艺对相应病毒的清除能力。”这是对基因治疗产品的病毒清除验证提出了要求。与抗体类产品所用指示病毒不同,基因治疗产品需要根据生产细胞系(Producing cells),载体病毒(Vector)或辅助病毒(Supporting virus)来选择。
根据药典要求:“应优先选择与潜在污染病毒密切相关的病毒,如相关病毒不能获取或不适于体外培养(如不能离体培养到足够高的滴度),可采用特异“模型”病毒代替。”
根据默克BioReliance®测试服务的项目经验,可推荐的指示病毒有:
l VSV(Vesicular Stomatitis Virus)作为狂犬病毒和昆虫弹状病毒的模型;
l PPV(Porcine Parvovirus)作为人源和牛源细小病毒的模型;
l EMC(Encephalomyo-carditis virus)作为人甲型肝炎病毒和小核糖核酸病毒的模型;
l AcMNPV(Autographa californica multicapsidnucleopolyhedrovirus)作为昆虫细胞系表达杆状病毒的模型等。
病毒清除验证上,由于基因治疗产品有更多样的下游纯化工艺,更紧迫的纯化周期,验证方案也更具有挑战。但相比于基于CHO发酵的产品,由于不存在基础的内源病毒颗粒数,对“病毒清除下降因子”的要求,也相应较低。
色谱法
“常用的特定病毒清除工艺包括巴氏消毒法、干热法、有机溶剂/去污剂(S/D)处理法、膜过滤法、低pH孵育法、色谱法等。”

此前,根据CDE的指导原则,IND阶段的除病毒验证,重点是验证纯化工艺中包含两步“不同机制的有效去除步骤”,去除/灭活达4logs以上的特定工艺步骤,通常国内申报只需要考察低pH/SD和纳滤两步。
国际申报的惯例,往往还会考察一步层析,由于阴离子流穿模式有较强的病毒去除能力,大多包括低pH/SD,阴离子层析和纳滤三个步骤。除了阴离子层析,在IND阶段也可以考察其他层析步骤的病毒清除能力,这会给BLA阶段的详细验证提供很好的参考价值。
2020新版药典,提到了“色谱法”,可见在国内IND申报中包含层析步骤,已经是大势所趋。但对于层析是否应该达到4logs的清除能力,应该不必苛求,除非是要将层析作为“有效去除步骤”。特别是针对不能加入纳滤的生产工艺,对层析步骤清除能力的要求,也应不少于4logs。
新版药典强调了“色谱法”,CDE指导原则中讲“层析步骤”,都是一个意思,都是英文单词Chromatography的中文翻译,只是在实验室规模上常用“色谱”,生产规模常用“层析”。
明确影响病毒清除效果的
关键工艺参数及控制范围
“应明确影响病毒清除效果的关键工艺参数及控制范围,并在此基础上建立充分的产品制备工艺过程的控制策略。”
除病毒验证的方案,在工艺参数选择上,建议选取最差条件(worst-case condition)。最差条件的选取,仅限于“关键工艺参数”,比如低pH孵育的pH上限和处理时间下限,并不是所有的操作参数都对清除效果有显著的影响。
在IND申报阶段,通常下游工艺还在优化进程中,特别是随着生产规模的放大,最差工艺条件也会不同。对尚在优化中的参数,通常可以选取操作设定值,而不必强求最差工艺条件。在BLA申报阶段,对最差条件有更加严苛的要求,如层析床层高度、线性流速选择、上样量等,都需要选取工艺范围内的最差条件。
如何“影响病毒清除效果的关键工艺参数及控制范围”,此前大多参数的选择,都是基于纯化机理和纯化经验总结而得的,大多都是“纸上谈兵”。新版药典提出了更高要求,已经将“清除效果”提升到关键质量属性(CQA)的水平,在下游工艺的开发与优化过程中,便需要以“清除效果”为目标,进行关键工艺参数(CPP)的优化。
很多生物药物都是基于平台技术,包含很多通用的、模块化的单元操作,如单抗药物的生产工艺,不同产品间的关键工艺参数是可以相互借鉴的。但对于新的产品或工艺中使用了新的技术,如前文所述的基因治疗产品,根据新药典的精神,就不能再通过“纸上谈兵”的方式来确定控制范围了。
采用新技术和新方法
“为提高病毒检出率,应尽可能采用先进的技术和方法用于病毒污染的检测。”
针对病毒污染的检测,传统的方法包括电子显微镜观察、体外细胞培养法、动物抗体生成法。随着今年来生物制药的爆炸式的增长,对检测效率、检测灵敏度的要求不断提升。新的技术,如QPCR(定量聚合酶链反应)技术和NGS(新一代测序技术)不断涌现,检测效率、灵敏度和重复性都明显提升。
由于大量的历史申报都是基于传统检测技术,申请人更倾向于采用稳健的检测方法,而不愿意承担尝试新技术的风险。新版药典提出“应尽可能采用先进的技术和方法”,是对新技术和新方法的积极推广。在疫情当下,鼓励使用新技术和新方法,为相关药品的加速上市,提供了有力的法规依据。
“拿到2020版药典之后,默克BioReliance®测试服务团队组织了多次认真学习,向业内专家请教,也多次跟同行一起探讨。在药典研读过程中,也得到专家的指导,得到默克法规与技术专家的支持,在此一并感谢。”
参考文献:
1、2020版《中国药典》
2、《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》
3、《新型冠状病毒中和抗体类药物技术资料要求(药学)(征求意见稿)》